氢
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外觀 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
無色氣體  等離子態下發出的淺紫光 氫的原子光譜 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 氫(Hydrogen)·H·1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 非金屬 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
族·週期·區 | 1 ·1·s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | (1.00784–1.00811)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | 1s1  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 發現 | 亨利·卡文迪什[2][3](1766年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 命名 | 安東萬-羅倫·德·拉瓦節[4](1783年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 顏色 | 無色 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 氣體 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (0 °C, 101.325 kPa) 0.08988 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
熔點時液體密度 | 0.07 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
沸點時液體密度 | 0.07099 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | 13.99 K,−259.16 °C,−434.49 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 20.271 K,−252.879 °C,−423.182 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 三相點 | 13.8033 K(−259 °C),7.041 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 臨界點 | 32.938 K,1.2858 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | (H2)0.117 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | (H2)0.904 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | (H2)28.836 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸汽壓
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | −1, +1 (兩性氧化物) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | 2.20(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:1312.0 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | 31±5 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德華半徑 | 120 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 六方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 抗磁性[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 0.1805 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 聲速 | 1310 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 1333-74-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:氫的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
氫是一種化學元素,其化學符號為H,原子序為1。氫的原子量為1.00794 u,是元素週期表中最輕的元素。單原子氫(H)是宇宙中最常見的化學物質,佔重子總質量的75%[6][註 1]。等離子態的氫是主序星的主要成份。氫的最常見同位素是「氕」(此名稱甚少使用,符號為H1{displaystyle {ce {^1H}}}

氫原子最早在宇宙復合階段出現並遍佈全宇宙。在標準溫度和壓力之下,氫形成雙原子分子(分子式為H2{displaystyle {ce {H2}}}


16世紀,人們通過混合金屬和強酸,首次製備出氫氣。1766至1781年,亨利·卡文迪什第一次發現氫氣是一種獨立的物質[8],燃燒後會產生水。安東萬-羅倫·德·拉瓦節根據這一性質,將其命名為「Hydrogen」,在希臘文中意為「生成水的物質」。19世纪50年代,英国医生合信编写《博物新编》(1855年)时,把元素名翻译为“轻气”,成為今天中文「氫」字的來源。[9][10]
氫氣的工業生產主要使用天然氣的蒸汽重整過程,或通過能源消耗更高的水電解反應[11]。大部份的氫氣都在生產地點直接使用,主要應用包括化石燃料處理(如裂化反應)和氨生產(一般用於化肥工業)。在冶金學上,氫氣會對許多金屬造成氫脆現象[12],使運輸管和儲存罐的設計更加複雜[13]。
目录
1 性質
1.1 燃燒
1.2 電子能級
1.3 單質分子形態
1.4 形态
1.5 化合物
1.5.1 共價及有機化合物
1.5.2 氫化物
1.5.3 質子與酸
1.6 同位素
2 歷史
2.1 發現及使用
2.2 量子理論
3 分佈
4 自然形成與實驗製備
4.1 金屬-酸反應
4.2 蒸汽重整
4.3 熱化學反應
4.4 無氧腐蝕作用
4.5 蛇紋石化反應
4.6 變壓器
5 應用
5.1 能量載體
6 生物過程
7 安全
8 註釋
9 參見
10 参考文献
11 延伸閱讀
12 外部連結
性質
燃燒

氫和氧在太空穿梭機主引擎中燃燒,在最大推力下產生近乎無色的火焰
氫氣(單原子或雙原子氫氣)[14]是一種高度易燃的物質,只要在空氣中體積比例在4%和75%之間就可燃燒[15]。氫的燃燒熱為−286kJ/mol:[16]
2H2+O2⟶2H2O+572{displaystyle {ce {2H2 + O2 -> 2H2O + 572}}}kJ (286 kJ/mol)[註 2]
氫氣與空氣混合濃度處於4%至74%時,或與氯氣混合濃度處於5%至95%時,會形成爆炸性混合物,可經火花、高溫或陽光點燃。氫氣在空氣中的自燃溫度為500 °C[17]。純氫氧混合氣在燃燒時發出紫外光,且在氧氣比例較高時,火焰是無色的──例如,太空穿梭機主引擎的火焰呈淡蓝色,但穿梭機固體助推器的火焰則顏色鮮豔。正在燃燒的氫氣洩漏點需要火焰探測器才能發現,所以非常危險。在其他情況下,氫氣的燃燒火焰呈藍色,與天然氣的火焰顏色相似。[18]
H2可以和所有氧化性元素發生反應。氫氣可以在室溫下與氯氣和氟氣自發產生劇烈反應,分別形成氯化氫和氟化氫兩種酸。[19]
電子能級

氫原子模型(圖示不按比例)
氫原子的電子基態能級為−13.6eV,[20]對應於波長約為91納米的紫外線光子。[21]
用玻爾原子模型可以很準確地計算出氫原子的各個能級,該模型假設電子圍繞著中心質子「公轉」,就像地球繞太陽公轉一樣。不同的是,電子和質子通過電磁力互相吸引,行星和恒星則通過重力相吸。早期量子力學假定角動量分立原理,電子和質子的距離只能取特殊的數值,因此電子在原子中也只能擁有特殊的能量值。[22]
要更準確地描述氫原子,須用到純量子力學理論中的薛定諤方程式、狄拉克方程式,甚至是費曼路徑積分表述,來計算電子在質子周圍的機率密度。[23]最複雜的計算可考慮到狹義相對論和真空極化效應。在量子力學的氫原子模型中,位於基態的電子不含任何角動量,可見「行星軌道」模型與事實情況有著根本性的分別。
單質分子形態

在貝法粒子加速器的液氫氣泡室觀測到的粒子軌跡
雙原子氫分子有兩個原子核相對自旋不同的自旋異構體。[24]其中正氫的兩個質子自旋平行,形成三重態,分子自旋量子數為1;仲氫的兩個質子自旋反平行,形成單重態,分子自旋量子數為0。在標準溫度和壓力下,氫氣含74.87%正氫和25.13%仲氫。[25]正氫和仲氫的平衡比例受溫度影響,但由於正氫屬於激發態,而非穩定態,所以無法純化分離出來。在極低溫度下,處於平衡狀態的氫幾乎完全由仲氫組成,如在25K下仲氫的含量為99.01%;隨著溫度的升高,正氫和仲氫的平衡比例趨向于3:1。[26]純正氫在液態和氣態時的熱力屬性與混合態截然不同,這是因為兩者在旋轉熱容上有很大的差異。[27]其他含氫分子和官能基也有正、仲之分,例如水和亞甲基,但它們在熱力屬性上的差別極小。[28]
在沒有催化劑的情況下,正氫和仲氫之間的轉換速率隨著溫度的升高而增加,所以急速冷卻的氫會含有高比例的仲氫,且這一仲氫會非常緩慢地轉變為正氫。[29]氫在冷卻後的正、仲比例對液氫的製備和儲存十分重要:仲氫向正氫的轉化是一個放熱過程,其產生的熱量足以使一部份液氫蒸發並流失出去。在氫冷卻過程中協助正、仲氫轉化的催化劑有:三氧化二鐵、活性炭、鉑石棉、稀土金屬、鈾化合物、
三氧化二鉻及某些鎳化合物等等[30][31]。
形态
- 气态氢
- 液态氢
- 三相点上的氢
- 固态氢
- 金属氢
化合物
共價及有機化合物
雖然H2{displaystyle {ce {H2}}}
氫和碳可形成名目繁多的化合物,稱為碳氫化合物,又稱烴;再加上各種雜原子,所能形成的化合物數量則更大。由於這些物質和生物息息相關,所以統稱有機化合物。[36]有機化學是對此類化學物屬性的研究,[37]而對有機化合物在生物體中的作用之研究,則稱為生物化學。[38]根據某些定義,有機化合物囊括所有含有碳的化合物。然而,大部份有機化合物同時也含有氫,而且是其中的碳-氫鍵賦予了它們獨特的化學性質,因此在另一些定義中,有機化合物必須含有碳-氫鍵。[36]現在已知的碳氫化合物以數百萬計,它們的合成途徑一般都十分複雜,而且很少會直接使用單質氫。
氫化物
含氫的化合物有時會稱為氫化物,但這一用詞並沒有嚴格的定義。氫化物一般是氫和電負性更低的元素結合而成,當中的氫呈負價,記作H−{displaystyle {ce {H-}}}



幾乎所有主族元素都可以形成氫化物,不過化種類數量卻有著巨大的差異。例如,已知的硼氫二元化合物共有100多種,但鋁氫二元化合物卻只有一種。[40]二元氫化銦還未被發現,但它存在於更大的銦氫配合物中。[41]
在無機化學中,氫化物還可用作橋接配體,連接配合物中的兩個金屬中心。這一用途在13族元素配合物中最為常見,特別是硼烷、鋁配合物和碳硼烷簇。[42]
質子與酸
氫在氧化後會失去它的電子,形成氫陽離子(H+{displaystyle {ce {H+}}}

質子H+{displaystyle {ce {H+}}}

為了避免認為溶液中存在裸露的質子,人們有時會把酸性水溶液中的陽離子記作H3O+{displaystyle {{ce {H3O+}}}}

儘管在地球上十分罕見,但H3+{displaystyle {ce {H3+}}}
同位素

氕放電管

氘放電管
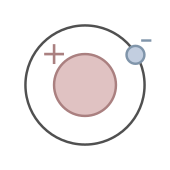
氕是最常見的氫同位素,含一個質子和一個電子。它是所有元素中唯一不含中子的穩定同位素
氫有三種天然同位素,分別為氕、氘、氚,記作H1{displaystyle {ce {^1H}}}




氕(H1{displaystyle {ce {^1H}}})是最常見的氫同位素,豐度高於99.98%。氕原子不含中子,只含一個質子和一個電子。[48]
氘(H2{displaystyle {ce {^2H}}},符號為D{displaystyle {ce {D}}}
)是氫的另一種穩定同位素,其原子核含有一個質子和一個中子。宇宙中幾乎所有的氘都是在大爆炸中形成的,殘留至今。氘不具放射性,亦無毒性。含氘的水分子稱為重水。氘以及含氘的化合物可以在化學實驗及氕核磁共振波譜法溶劑中,作為非放射性標識。[49]在核反應爐中,重水是一種中子減速劑和冷卻劑。氘也有潛力成為商業核聚變反應的燃料。[50]
氚(H3{displaystyle {ce {^3H}}})(T{displaystyle {ce {T}}}
) 的原子核含有一個質子和兩個中子。氚具有放射性,會β衰變成氦-3,半衰期為12.32年。[42]它的放射性可用於發光顏料,例如夜光鐘錶等(錶面玻璃可阻擋其輻射)。[51]因為宇宙射線和大氣氣體的相互作用會造成核嬗變,再加上多次核武器試驗的輻射性微塵,所以自然界中存在少量的氚。[52]氚的應用包括:核聚變反應、[53]同位素地球化學示蹤劑[54]以及自發光照明器材,[55]並可在化學和生物學實驗中用作放射性標識。[56]
氫是唯一一個同位素各自擁有不同名稱的元素。在放射性研究的早期,其他更重的同位素都有自己的名稱,但至今仍在廣泛使用的就只剩下氘和氚。H2{displaystyle {ce {^2H}}}










歷史
發現及使用
1671年,羅拔·波義耳發現鐵屑和稀釋酸之間會發生反應,並產生氣體──就是氫氣。[59][60]1766年,亨利·卡文迪什同樣利用金屬和酸之間的反應,首次發現氫氣是一種獨立的物質,並將其命名為「易燃氣」。他猜想,「易燃氣」就是當時假想的燃素。[61][62]1781年,他又發現該氣體在燃燒後會生成水。故此,卡文迪什一般被後世尊為氫元素的發現者。[2][3]1783年,安東萬-羅倫·德·拉瓦節和皮耶爾-西蒙·拉普拉斯重複並證實了卡文迪什的實驗。拉瓦節為這一元素命名為「Hydrogen」,詞源為希臘文中的「水」(ὑδρο)和「創造者」(-γενής)。[4][3]

安東萬-羅倫·德·拉瓦節
在拉瓦節的實驗中,蒸汽在一支用火燒熱的鐵管內流通,高溫下水分子中的質子會對鐵金屬進行無氧性氧化反應,產生氫氣。此反應的方程式如下:
- Fe+H2O⟶FeO+H2{displaystyle {ce {Fe + H2O -> FeO + H2}}}
- 2Fe+3H2O⟶Fe2O3+3H2{displaystyle {ce {2Fe + 3H2O -> Fe2O3 + 3H2}}}
- 3Fe+4H2O⟶Fe3O4+4H2{displaystyle {ce {3Fe + 4H2O -> Fe3O4 + 4H2}}}
不少金屬都可以代替鐵,進行以上的化學反應而產生氫氣,例如鋯。
1898年,詹姆斯·杜瓦用再生冷卻法及他所發明的真空保溫瓶,首次製成液氫。[3]翌年,他又製成固體氫。[3]哈羅德·尤里於1931年12月發現氘,而歐内斯特·盧瑟福、馬克·奧利芬特和保羅·哈特克則在1934年首次製備出氚。[2]尤里的研究小組在1932年發現重水,即含有氘的水。[3]1806年,弗朗斯瓦·伊薩克·德·利瓦製造了第一部以氫氧混合物作為燃料的內燃機──德利瓦引擎。愛德華·丹尼爾·克拉克在1819年發明了氫氣吹管。德貝萊納燈和聚光燈則在1823年被發明。[3]
1783年,雅克·沙爾發明了首個氫氣球。[3]1852年,亨利·吉法爾發明了首個以氫氣提供升力的載人飛艇。[3]德國的斐迪南·馮·齊柏林伯爵大力推廣了這一運輸工具,他所設計的飛船稱作齊柏林飛船,於1900年首飛。[3]飛船的常規航班從1910年開始,到了1914年8月第一次世界大戰之始已搭載3萬5千多人,並無重大事故。氫氣飛船在戰時被用於觀測及轟炸。
1919年,R34飛船首次不停站橫跨大西洋。常規客運航班在1920年代陸續恢復。雖然當時在美國發現了氦氣儲備,但美國政府不願售賣氦氣作運輸之用。因此興登堡號飛船所使用的仍然是氫氣,飛船於1937年5月6日準備降落於新澤西州時,在半空中起火焚燒並墜毀。[3]整個事故經电视直播,且全程被拍攝下來。人們最早認為是洩漏的氫氣爆炸造成了這場事故,但之後的調查卻指出,是飛船鍍鋁的表面布料被靜電點燃引致起火。
1937年,第一部氫冷汽輪發電機在俄亥俄州代頓投入使用,這種發電機以氫氣作為轉子和定子的冷卻劑。[63]由於氫氣的導熱性極佳,所以至今仍是最常用的發電機冷卻劑。
1977年,美國海軍的導航科技2號衛星(NTS-2)搭載了首個鎳氫電池。[64]國際太空站、[65]2001火星奧德賽號[66]及火星全球探勘者號[67]都配備了鎳氫電池。處於地球陰影部份的時候,哈勃太空望遠鏡也是由鎳氫電池供電的。[68]這個電池在運作19年後(超過設計年期13年),終於在2009年5月被更換下來。[69]
量子理論

氫在可見光範圍內的發射光譜共有巴耳末系的四條譜線
氫是原子結構最為簡單的元素,只含一個質子和一個電子。在原子結構模型的發展過程中,氫原子和它的發射、吸收光譜都有著特殊的理論價值。[70]物理學家在1925年前後發展出氫原子的量子力學描述,此後氫分子以及H2+{displaystyle {ce {H2+}}}
早在量子力學發展成熟整整半個世紀以前,詹姆斯·克拉克·馬克士威就觀察到了氫的量子效應。他注意到,H2{displaystyle {ce {H2}}}

反氫(H¯{displaystyle {overline {mathrm {H} }}}
分佈

NGC 604是三角座星系中一個巨大的電離氫區
氫是宇宙中豐度最高的化學元素,佔重子總質量的75%,原子總數的90%以上。(不過,宇宙的大部份質量並不是由化學元素物質所組成的,而是有待進一步了解的暗物質和暗能量。)[74]氫是恒星和巨行星的主要成份之一,並通過質子﹣質子鏈反應和碳氮氧循環核聚變反應為恒星提供能量。H2分子雲是恒星形成的地點。[75]
宇宙中的氫主要以單原子形態和等離子態存在,此兩者的性質和雙原子氫分子頗為不同。氫等離子體中,電子和質子各自獨立,所以電導率和發射率都很高,這是太陽等恒星發光的原因。這些帶電粒子受電磁場的影響,例如,太陽風會和地球磁層相互作用,產生白克蘭電流和極光。星際物質含有中性單原子氫。直到紅移z=4{displaystyle z=4}
在地球上的常規條件下,氫的單質以雙原子氣體存在,即H2{displaystyle {ce {H2}}}
星際物質中的氫分子經宇宙射線的電離之後,會形成三氫陽離子(H3+{displaystyle {ce {H3+}}}


自然形成與實驗製備
在實驗室中,不少化學反應都會釋放氫氣作為副產品。工業生產出的氫可以用來氫化各種不飽和物質。在自然界中,生物體的還原反應也會釋放出氫氣。
金屬-酸反應
在實驗室中製備氫氣,一般用非氧化酸與反應性較高的金屬(如鋅)在啟普發生器中發生反應:
- Zn+2H+⟶Zn2++H2{displaystyle {ce {Zn + 2H+ -> Zn^2+ + H2}}}
鋁經過鹼的處理後,也會產生氫氣:
- 2Al+6H2O+2OH−⟶2Al(OH)4−+3H2{displaystyle {ce {2Al + 6H2O + 2OH- ->2Al(OH)4- + 3H2}}}
對水進行電解,可以很容易地製成氫氣。當低電壓的電流通過水的時候,氧氣會在陽極積累,而氫氣則在陰極積累。在製備氫氣作儲存之用時,陰極的材料一般選用鉑等惰性金屬,以避免與氫氣發生反應。如果製成的氫氣須要當場用來燃燒,則氧氣可助燃,所以陽極也應該用惰性金屬作為材料。理論上的最大能源效率,即產出的氫氣所含潛在能量佔投入電能的比例,為80%至94%。[81]
- 2H2O⟶2H2+O2{displaystyle {ce {2H2O -> 2H2 + O2}}}
用鋁鎵合金製成的顆粒,加入水中,會產生氫氣。這一反應也會產生氧化鋁,但用於防止顆粒表面形成氧化層、成本較高的鎵在反應之後可以回收再用。這一反應有潛力成為氫能經濟的基礎,因為氫氣可以在現場生成,無須運輸。[82]
蒸汽重整
在眾多氫氣製備方法中,經濟效益最高的是從碳氫化合物中提取出氫氣。商業上,一般是對天然氣進行蒸汽重整來大規模生產氫氣。[83]在高溫下(1000–1400K,700–1100°C,1300–2000°F),水蒸汽和甲烷會發生反應,產生一氧化碳和氫氣:
- CH4+H2O⟶CO+3H2{displaystyle {ce {CH4 + H2O -> CO +3H2}}}
以上的反應在低壓進行時效率更高,但卻通常在高壓下進行(2.0MPa,20atm,600inHg),因為高壓氫氣是市場上最為普及,且變壓吸附純化系統更適合在高壓下工作。由於反應所產生的一氧化碳-氫氣混合物經常直接用於生產甲醇及其他相關的化合物,所以也稱為合成氣。甲烷以外的碳氫化合物也可以用來製造合成氣,但產物比例可能會有所不同。在缺水的情況下,焦炭就會形成,影響合成氣的產量:
- CH4⟶C+2H2{displaystyle {ce {CH4 -> C + 2H2}}}
因此,在進行蒸汽重整過程時,通常應注入過量的蒸汽。利用水氣轉移反應,並以氧化鐵作為催化劑,可從蒸汽中提取出更多的氫氣。蒸汽重整也是二氧化碳的一大工業來源:[83]
- CO+H2O⟶CO2+H2{displaystyle {ce {CO + H2O -> CO2 + H2}}}
氫氣的其他生產方法還包括,碳氫化合物的部份氧化反應:[84]
- 2CH4+O2⟶2CO+4H2{displaystyle {ce {2CH4 + O2 -> 2CO + 4H2}}}
以及對煤炭反應的碳產物進行以上的轉移反應:[83]
- C+H2O⟶CO+H2{displaystyle {ce {C + H2O -> CO + H2}}}
氫氣在生產後,有時會在同一道工業程序中直接被使用,期間不經分離。在用於生產氨的哈柏法中,氫氣是從天然氣中提取出來的。[85]對鹽水進行電解,在產生氯氣的同時,也會生成氫氣作為副產品。[86]
熱化學反應
能分離水的熱化學循環過程共有200多種,其中可以從水和熱量直接產生氫氣和氧氣的過程包括:氧化鐵循環、氧化鈰(IV)-氧化鈰(III)循環、鋅-氧化鋅循環、硫碘循環、銅氯循環、混合硫循環等等,都有待進一步研究。[87]多個國家都有實驗室著力研究可以從太陽能和水生成氫氣的熱化學方法。[88]
無氧腐蝕作用
在無氧條件下,鐵和合成鋼會被水分子中的質子緩慢氧化,而水則會還原成分子氫。在鐵的無氧腐蝕過程中,首先形成的是氫氧化亞鐵(Fe(OH)2{displaystyle {{ce {Fe(OH)2}}}}
- Fe+2H2O⟶Fe(OH)2+H2{displaystyle {ce {Fe + 2H2O -> Fe(OH)2 + H2}}}
水分子中的質子再對氫氧化亞鐵進行無氧性氧化反應,產生磁鐵礦(Fe3O4{displaystyle {ce {Fe3O4}}}
- 3Fe(OH)2⟶Fe3O4+2H2O+H2{displaystyle {ce {3Fe(OH)2 -> Fe3O4 + 2H2O + H2}}}
磁鐵礦晶體的熱力學穩定性比氫氧化亞鐵高。
在缺氧地下水和位於地下水台以下具還原性的土壤中,鐵和鋼就是經過這一反應受無氧侵蝕的。
蛇紋石化反應
在地底深處缺乏大氣氧氣的環境下,鐵橄欖石晶格中的矽酸鐵會受到水分子中的質子的無氧性氧化,產生氫氣,這叫蛇紋石化作用。除了氫氣以外,反應還會產生磁鐵礦(Fe3O4{displaystyle {ce {Fe3O4}}}

- 3Fe2SiO4+2H2O⟶2Fe3O4+3SiO2+3H2{displaystyle {ce {3Fe2SiO4 + 2H2O -> 2Fe3O4 + 3SiO2 +3H2}}}
以上反應和氫氧化二鐵的無氧腐蝕過程(西科爾反應)十分相似。
變壓器
在變壓器會產生的各種故障氣體中,氫氣是最常見的一種,在大部份故障情況下都會形成。所以,探測到氫氣,意味著變壓器可能出現了嚴重的問題。[89]
應用
石油和化學工業都需要大量的氫氣,其中以化石燃料加工及經哈伯法生產氨為主要應用。在石油化工廠中須消耗氫氣的過程有:加氫脫烷基反應、加氫脫硫反應和裂化反應等。氫氣可以用來對非飽和脂肪和油類進行氫化,增加飽和程度(如固體植物牛油),也可以用於生產甲醇和氫氯酸。氫氣可以對金屬礦物進行還原。[90]
氫氣極易溶於許多稀土金屬和過渡金屬之中,[91]同時也可溶於納米晶態和非晶態金屬。[92]氫氣在金屬中的可溶性受到了晶格局部變形和雜質的影響。[93]利用這一屬性,可將氫氣在高溫鈀圓盤上通過,提高氫氣的純度。不過,氫氣在金屬中的溶解會導致氫脆現象,[12]使運輸管和儲存罐的設計更為複雜。[13]
除了用在化學反應中以外,氫氣在物理學和工程學上也有廣泛的應用。它在一些焊接方法中可用作保護氣體,例如原子氫焊接法。[94][95]氫氣的分子質量很低,因此它密度低,熱容量和熱導率亦為所有氣體中最高,很適合用作發電機的轉子冷卻劑。液氫可用於低溫物理學中,例如對超導現象的研究。[96]氫氣的質量密度很低,稍高於空氣密度的四分之一,所以氣球和飛艇都曾經用氫氣來提供升力。[97]但1937年的興登堡號空難造成36人死亡後,氫氣在載人飛般及氣球填充上的應用已被較穩定的氦氣所完全取代。[98]
氫氣和氮氣混合後稱為合成氣體,可以作為示蹤氣體,用於探測微小的漏氣點,在汽車、化學、發電、航空航天和電信等工業中都有應用的空間。[99]氫氣在許多國家屬於合法的食物添加劑(E 949),可以用來探測包裝有無洩漏,以及防止食物氧化。[100]
氫可以用來飽和無定形碳和無定性矽的斷鍵(懸鍵),使物質屬性變得更加穩定。[101]氫在各種氧化物材料中可以作為電子供體,包括:ZnO、[102][103]SnO2、CdO、MgO、[104]ZrO2、HfO2、La2O3、Y2O3、TiO2、SrTiO3、LaAlO3、SiO2、Al2O3、ZrSiO4、HfSiO4和SrZrO3等。[105]
氘和氚同位素也有其各自的特殊應用。氘可用於核聚變反應中,也可用作核裂變反應的中子減速劑。[3]化學和生物學都會利用氘化合物來研究各種化學反應的動力學同位素效應。[106]核反應爐所產生的氚可以用來製造氫彈,[107]在生物科學中用作同位素標識,[56]以及在發光顏料中作為輻射源。[108]
1990年國際實用溫標(ITS-90)把氫在平衡態下的三相點溫度定義為13.8033 K,從而為開爾文溫標定下了國際標準。[109]
能量載體
氫本身並不是一種能源資源。[110]利用氘或氚同位素來進行核聚變發電的技術,目前還遠沒有達到發展成熟的階段。[111]雖然太陽的能量來自於氫的核聚變反應,但要在地球上穩定控制這一過程卻是極為困難的。[112]用太陽能、電能或生物過程產生單質氫所需要的能量,比氫燃燒後所得的能量要高,所以氫只能是一種能量載體,就像電池一樣。氫可以取自甲烷等化石燃料,但這些燃料都屬於不可再生資源。[110]
液氮和壓縮氫氣的單位體積所含能量密度比傳統燃料低得多,但單位質量所含能量密度卻更加高。[110]氫氣被認為有潛力成為一種常用的能源載體,作為新的經濟基礎。[113]舉例來說,在從化石燃料提取氫氣的同時,可以對二氧化碳進行收集及封存。[114]汽車在燃燒氫氣時的污染較低,除一些氮氧化物以外,[115]不會排放任何的碳。[114]燃料電池將氫氣和氧氣轉化為電力,效率比內燃機更高。[116]然而,要從現狀完全轉變到氫經濟,則需要龐大的基建成本。[117]
生物過程
某些類型的無氧代謝反應會產生氫氣。會釋出氫氣的微生物一般以含鐵或含鎳的氫化酶作為催化劑,進行以下的可逆氧化還原反應:
- H2↽−−⇀2H++2e−{displaystyle {ce {H2 <=> 2H+ +2e-}}}
在丙酮酸鹽發酵成水的過程中,還原當量(任何在氧化還原反應中可轉移單個電子的化學物)轉移時會產生氫氣。[118]生物體內氫的自然產生和消耗稱為氫循環。[119]
所有光和生物所進行的光反應都會把水分解成質子、電子和氧氣。在某些生物中,如萊茵衣藻和藍綠藻等,演化出了「暗反應」的第二階段:質子和電子通過葉綠體的特殊氫化酶還原成氫氣。[120]一些科學家正在研究用基因改造方法,使水藻和藍綠藻的氫化酶在有氧環境下也能高效合成氫氣。[121][122]
安全
氫在不同情況下都會對人體造成危險。與空氣混合時,氫氣會輕易燃燒和爆炸,而純氫氣則會使人窒息。[123]洩漏到空氣中的氫氣無色無味,且可以自燃,產生高溫但無色的火焰,因此有意外灼傷的可能性。[124]液氫的溫度極低,所以和其他低溫液體一樣有一定的危險性,比如會引致凍傷。[125]氫氣可以溶解在多種金屬之中,除了可能的洩漏以外,氫氣還會造成金屬的氫脆現象,[126]引致材料爆裂。[127]
氫的許多性質都受到了其自旋異構體(正氫和仲氫)比例的影響。不少數據所描述的是處於平衡態的氫氣,但氫氣有時需要幾天乃至幾週的時間才會達致平衡,所以它的安全數據可能和現實中的氫氣有所差別。另外,容器的形狀,也會大大影響氫氣的爆炸臨界溫度和壓力。[123]
註釋
^ 宇宙中絕大部份的質量並不是由重子或化學元素組成。參見:暗物質和暗能量。
^ 286 kJ/mol:每摩爾可燃燒物質(氫分子)所產生的能量
參見
- 反氫
- 氫的同位素
- 氕
- 氘
- 氚
参考文献
^ Standard Atomic Weights 2013. Commission on Isotopic Abundances and Atomic Weights
^ 2.02.12.2 Hydrogen. Van Nostrand's Encyclopedia of Chemistry. Wylie-Interscience: 797–799. 2005. ISBN 0-471-61525-0.
^ 3.003.013.023.033.043.053.063.073.083.093.103.11 Emsley, John. Nature's Building Blocks. Oxford: Oxford University Press. 2001: 183–191. ISBN 0-19-850341-5.
^ 4.04.1 Stwertka, Albert. A Guide to the Elements. Oxford University Press. 1996: 16–21. ISBN 0-19-508083-1.
^
Magnetic susceptibility of the elements and inorganic compounds (PDF). CRC Handbook of Chemistry and Physics 81st. CRC Press. (原始内容 (PDF)存档于2012-01-12).
^
Palmer, D. Hydrogen in the Universe. NASA. 1997-09-13 [2008-02-05].
^ Laursen, S.; Chang, J.; Medlin, W.; Gürmen, N.; Fogler, H. S. An extremely brief introduction to computational quantum chemistry. Molecular Modeling in Chemical Engineering. University of Michigan. 2004-07-27 [2015-05-04].
^
Presenter: Professor Jim Al-Khalili. Discovering the Elements. Chemistry: A Volatile History. 25:40 记录于. 21 January 2010. BBC. BBC Four.
^ 李海. 化学元素的中文名词是怎样制定的. 化学教学. 1989, (3): 032 [2016-01-09].
^ 袁振东; 张锦. 论中国化学教育的起源. 化学教育. 2011, 32 (12): 89–92 [2016-01-09]. doi:10.3969/j.issn.1003-3807.2011.12.032. 引文使用过时参数coauthors (帮助)
^ Hydrogen Basics — Production. Florida Solar Energy Center. 2007 [2008-02-05].
^ 12.012.1 Rogers, H. C. Hydrogen Embrittlement of Metals. Science. 1999, 159 (3819): 1057–1064. Bibcode:1968Sci...159.1057R. PMID 17775040. doi:10.1126/science.159.3819.1057.
^ 13.013.1 Christensen, C.H.; Nørskov, J. K.; Johannessen, T. Making society independent of fossil fuels — Danish researchers reveal new technology. Technical University of Denmark. 2005-07-09 [2015-05-19].
^
Dihydrogen. O=CHem Directory. University of Southern Maine. [2009-04-06]. (原始内容存档于2009-02-13).
^
Carcassi, M. N.; Fineschi, F. Deflagrations of H2–air and CH4–air lean mixtures in a vented multi-compartment environment. Energy. 2005, 30 (8): 1439–1451. doi:10.1016/j.energy.2004.02.012.
^
Committee on Alternatives and Strategies for Future Hydrogen Production and Use, US National Research Council, US National Academy of Engineering. The Hydrogen Economy: Opportunities, Costs, Barriers, and R&D Needs. National Academies Press. 2004: 240. ISBN 0-309-09163-2.
^ Patnaik, P. A Comprehensive Guide to the Hazardous Properties of Chemical Substances. Wiley-Interscience. 2007: 402. ISBN 0-471-71458-5.
^ Schefer, E. W.; Kulatilaka, W. D.; Patterson, B. D.; Settersten, T. B. Visible emission of hydrogen flames. Combustion and Flame. June 2009, 156 (6): 1234–1241. doi:10.1016/j.combustflame.2009.01.011.
^
Clayton, D. D. Handbook of Isotopes in the Cosmos: Hydrogen to Gallium. Cambridge University Press. 2003. ISBN 0-521-82381-1.
^ NAAP Labs. Energy Levels. University of Nebraska Lincoln. 2009 [2015-05-20].
^ photon wavelength 13.6 eV. Wolfram Alpha. 2015-05-20 [2015-05-20].
^ Stern, D.P. The Atomic Nucleus and Bohr's Early Model of the Atom. NASA Goddard Space Flight Center (mirror). 2005-05-16 [2007-12-20].
^ Stern, D. P. Wave Mechanics. NASA Goddard Space Flight Center. 2005-02-13 [2008-04-16].
^ Staff. Hydrogen (H2) Properties, Uses, Applications: Hydrogen Gas and Liquid Hydrogen. Universal Industrial Gases, Inc. 2003 [2008-02-05].
^ Tikhonov, V. I.; Volkov, A. A. Separation of Water into Its Ortho and Para Isomers. Science. 2002, 296 (5577): 2363. PMID 12089435. doi:10.1126/science.1069513.
^ 《無機化學叢書》(第一卷). 科學出版社. : 153.
^ Hritz, J. CH. 6 – Hydrogen (PDF). NASA Glenn Research Center Glenn Safety Manual, Document GRC-MQSA.001. NASA. March 2006 [2008-02-05].
^ Shinitzky, M.; Elitzur, A. C. Ortho-para spin isomers of the protons in the methylene group. Chirality. 2006, 18 (9): 754–756. PMID 16856167. doi:10.1002/chir.20319.
^ Milenko, Yu. Ya.; Sibileva, R. M.; Strzhemechny, M. A. Natural ortho-para conversion rate in liquid and gaseous hydrogen. Journal of Low Temperature Physics. 1997, 107 (1–2): 77–92. Bibcode:1997JLTP..107...77M. doi:10.1007/BF02396837.
^ Amos, Wade A. Costs of Storing and Transporting Hydrogen (PDF). National Renewable Energy Laboratory: 6–9. 1998-11-01 [2015-05-19].
^ Svadlenak, R. E.; Scott, A. B. The Conversion of Ortho- to Parahydrogen on Iron Oxide-Zinc Oxide Catalysts. Journal of the American Chemical Society. 1957, 79 (20): 5385–5388. doi:10.1021/ja01577a013.
^ Clark, J. The Acidity of the Hydrogen Halides. Chemguide. 2002 [2008-03-09].
^ Kimball, J. W. Hydrogen. Kimball's Biology Pages. 2003-08-07 [2008-03-04].
^ IUPAC Compendium of Chemical Terminology, Electronic version, Hydrogen Bond
^ Sandrock, G. Metal-Hydrogen Systems. Sandia National Laboratories. 2002-05-02 [2008-03-23]. (原始内容存档于2008-02-24).
^ 36.036.1 Structure and Nomenclature of Hydrocarbons. Purdue University. [2008-03-23].
^ Organic Chemistry. Dictionary.com. Lexico Publishing Group. 2008 [2008-03-23].
^ Biochemistry. Dictionary.com. Lexico Publishing Group. 2008 [2008-03-23].
^ Moers, K. Investigations on the Salt Character of Lithium Hydride. Zeitschrift für Anorganische und Allgemeine Chemie. 1920, 113 (191): 179–228. doi:10.1002/zaac.19201130116.
^ Downs, A. J.; Pulham, C. R. The hydrides of aluminium, gallium, indium, and thallium: a re-evaluation. Chemical Society Reviews. 1994, 23 (3): 175–184. doi:10.1039/CS9942300175.
^ Hibbs, D. E.; Jones, C.; Smithies, N. A. A remarkably stable indium trihydride complex: synthesis and characterisation of [InH3P(C6H11)3]. Chemical Communications. 1999, (2): 185–186. doi:10.1039/a809279f.
^ 42.042.142.2 Miessler, G. L.; Tarr, D. A. Inorganic Chemistry 3rd. Prentice Hall. 2003. ISBN 0-13-035471-6.
^ Okumura, A. M.; Yeh, L. I.; Myers, J. D.; Lee, Y. T. Infrared spectra of the solvated hydronium ion: vibrational predissociation spectroscopy of mass-selected H3O+•(H2O)n•(H2)m. Journal of Physical Chemistry. 1990, 94 (9): 3416–3427. doi:10.1021/j100372a014.
^ Perdoncin, G.; Scorrano, G. Protonation Equilibria in Water at Several Temperatures of Alcohols, Ethers, Acetone, Dimethyl Sulfide, and Dimethyl Sulfoxide. Journal of the American Chemical Society. 1977, 99 (21): 6983–6986. doi:10.1021/ja00463a035.
^ Carrington, A.; McNab, I. R. The infrared predissociation spectrum of triatomic hydrogen cation (H3+). Accounts of Chemical Research. 1989, 22 (6): 218–222. doi:10.1021/ar00162a004.
^ Gurov, Y. B.; Aleshkin, D. V.; Behr, M. N.; Lapushkin, S. V.; Morokhov, P. V.; Pechkurov, V. A.; Poroshin, N. O.; Sandukovsky, V. G.; Tel'kushev, M. V.; Chernyshev, B. A.; Tschurenkova, T. D. Spectroscopy of superheavy hydrogen isotopes in stopped-pion absorption by nuclei. Physics of Atomic Nuclei. 2004, 68 (3): 491–97. Bibcode:2005PAN....68..491G. doi:10.1134/1.1891200.
^ Korsheninnikov, A.; Nikolskii, E.; Kuzmin, E.; Ozawa, A.; Morimoto, K.; Tokanai, F.; Kanungo, R.; Tanihata, I.; 等. Experimental Evidence for the Existence of 7H and for a Specific Structure of 8He. Physical Review Letters. 2003, 90 (8): 082501. Bibcode:2003PhRvL..90h2501K. doi:10.1103/PhysRevLett.90.082501.
^ Urey, H. C.; Brickwedde, F. G.; Murphy, G. M. Names for the Hydrogen Isotopes. Science. 1933, 78 (2035): 602–603. Bibcode:1933Sci....78..602U. PMID 17797765. doi:10.1126/science.78.2035.602.
^ Oda, Y.; Nakamura, H.; Yamazaki, T.; Nagayama, K.; Yoshida, M.; Kanaya, S.; Ikehara, M. 1H NMR studies of deuterated ribonuclease HI selectively labeled with protonated amino acids. Journal of Biomolecular NMR. 1992, 2 (2): 137–47. PMID 1330130. doi:10.1007/BF01875525.
^ Broad, W. J. Breakthrough in Nuclear Fusion Offers Hope for Power of Future. The New York Times. 1991-11-11 [2008-02-12].
^ Traub, R. J.; Jensen, J. A. Tritium radioluminescent devices, Health and Safety Manual (PDF). International Atomic Energy Agency: 2.4. June 1995 [2015-05-20].
^ Staff. Tritium. U.S. Environmental Protection Agency. 2007-11-15 [2008-02-12].
^ Nave, C. R. Deuterium-Tritium Fusion. HyperPhysics. Georgia State University. 2006 [2008-03-08].
^ Kendall, C.; Caldwell, E. Fundamentals of Isotope Geochemistry. US Geological Survey. 1998 [2008-03-08].
^ The Tritium Laboratory. University of Miami. 2008 [2008-03-08]. (原始内容存档于2008年2月28日).
^ 56.056.1 Holte, A. E.; Houck, M. A.; Collie, N. L. Potential Role of Parasitism in the Evolution of Mutualism in Astigmatid Mites. Experimental and Applied Acarology (Lubbock: Texas Tech University). 2004, 25 (2): 97–107. doi:10.1023/A:1010655610575.
^ van der Krogt, P. Hydrogen. Elementymology & Elements Multidict. 2005-05-05 [2010-12-20].
^ § IR-3.3.2, Provisional Recommendations, Nomenclature of Inorganic Chemistry, Chemical Nomenclature and Structure Representation Division, IUPAC. Accessed on line 3 October 2007.
^ Boyle, R. (1672). "Tracts written by the Honourable Robert Boyle containing new experiments, touching the relation betwixt flame and air..." London.
^ Winter, M. Hydrogen: historical information. WebElements Ltd. 2007 [2008-02-05].
^ Musgrave, A. Why did oxygen supplant phlogiston? Research programmes in the Chemical Revolution. (编) Howson, C. Method and appraisal in the physical sciences. The Critical Background to Modern Science, 1800–1905. Cambridge University Press. 1976 [2011-10-22].
^ Cavendish, Henry. Three Papers, Containing Experiments on Factitious Air, by the Hon. Henry Cavendish, F. R. S.. Philosophical Transactions (The Royal Society). 1766-05-12, 56: 141–184 [2015-05-20].
^ National Electrical Manufacturers Association. A chronological history of electrical development from 600 B.C. 1946: 102.
^ NTS-2 Nickel-Hydrogen Battery Performance 31. Aiaa.org. [2009-04-06].
^ Jannette, A. G.; Hojnicki, J. S.; McKissock, D. B.; Fincannon, J.; Kerslake, T. W.; Rodriguez, C. D. Validation of international space station electrical performance model via on-orbit telemetry (PDF). IECEC '02. 2002 37th Intersociety Energy Conversion Engineering Conference, 2002. July 2002: 45–50 [2011-11-11]. ISBN 0-7803-7296-4. doi:10.1109/IECEC.2002.1391972.
^ Anderson, P. M.; Coyne, J. W. A lightweight high reliability single battery power system for interplanetary spacecraft. Aerospace Conference Proceedings. 2002, 5: 5–2433. ISBN 0-7803-7231-X. doi:10.1109/AERO.2002.1035418.
^ Mars Global Surveyor. Astronautix.com. [2009-04-06]. (原始内容存档于2009-08-10).
^ Lori Tyahla (编). Hubble servicing mission 4 essentials. NASA. 2009-05-07 [2015-05-19].
^ Hendrix, Susan. Lori Tyahla, 编. Extending Hubble's mission life with new batteries. NASA. 2008-11-25 [2015-05-19].
^ Crepeau, R. Niels Bohr: The Atomic Model. Great Scientific Minds (Great Neck Publishing). 2006-01-01. ISBN 1-4298-0723-7.
^ Berman, R.; Cooke, A. H.; Hill, R. W. Cryogenics. Annual Review of Physical Chemistry. 1956, 7: 1–20. Bibcode:1956ARPC....7....1B. doi:10.1146/annurev.pc.07.100156.000245.
^ Charlton, Mike; Van Der Werf, Dirk Peter. Advances in antihydrogen physics. Science Progress. 2015-03-01, 98 (1): 34–62. doi:10.3184/003685015X14234978376369.
^ Kellerbauer, Alban. Why Antimatter Matters. European Review. 2015-01-29, 23 (01): 45–56. doi:10.1017/S1062798714000532.
^ Gagnon, S. Hydrogen. Jefferson Lab. [2008-02-05].
^ Haubold, H.; Mathai, A. M. Solar Thermonuclear Energy Generation. Columbia University. 2007-11-15 [2008-02-12]. (原始内容存档于2011-12-11).
^ Storrie-Lombardi, L. J.; Wolfe, A. M. Surveys for z > 3 Damped Lyman-alpha Absorption Systems: the Evolution of Neutral Gas. Astrophysical Journal. 2000, 543 (2): 552–576. Bibcode:2000ApJ...543..552S. arXiv:astro-ph/0006044. doi:10.1086/317138.
^ Dresselhaus, M.; 等. Basic Research Needs for the Hydrogen Economy (PDF). Argonne National Laboratory, U.S. Department of Energy, Office of Science Laboratory. 2003-05-15 [2008-02-05]. (原始内容 (PDF)存档于2008-02-13).
^ Berger, W. H. The Future of Methane. University of California, San Diego. 2007-11-15 [2008-02-12].
^ McCall Group; Oka Group. H3+ Resource Center. Universities of Illinois and Chicago. 2005-04-22 [2008-02-05].
^ Helm, H.; 等. Coupling of Bound States to Continuum States in Neutral Triatomic Hydrogen (PDF). Department of Molecular and Optical Physics, University of Freiburg, Germany. [2009-11-25]. [永久失效連結]
^ Kruse, B.; Grinna, S.; Buch, C. Hydrogen Status og Muligheter (PDF). Bellona. 2002 [2008-02-12]. (原始内容 (PDF)存档于2008-02-16).
^ Venere, E. New process generates hydrogen from aluminum alloy to run engines, fuel cells. Purdue University. 2007-05-15 [2008-02-05].
^ 83.083.183.2 Oxtoby, D. W. Principles of Modern Chemistry 5th. Thomson Brooks/Cole. 2002. ISBN 0-03-035373-4.
^ Hydrogen Properties, Uses, Applications. Universal Industrial Gases, Inc. 2007 [2008-03-11].
^ Funderburg, E. Why Are Nitrogen Prices So High?. The Samuel Roberts Noble Foundation. 2008 [2008-03-11]. (原始内容存档于2001-05-09).
^ Lees, A. Chemicals from salt. BBC. 2007 [2008-03-11]. (原始内容存档于2007-10-26).
^ Weimer, Al. Development of solar-powered thermochemical production of hydrogen from water (PDF). Solar Thermochemical Hydrogen Generation Project. 2005-05-25.
^ Perret, R. Development of Solar-Powered Thermochemical Production of Hydrogen from Water, DOE Hydrogen Program, 2007 (PDF). [2008-05-17].
^ Hirschler, M. M. Electrical Insulating Materials: International Issues. ASTM International. 2000: 89– [2012-07-13]. ISBN 978-0-8031-2613-8.
^ Chemistry Operations. Hydrogen. Los Alamos National Laboratory. 2003-12-15 [2008-02-05].
^
Takeshita, T.; Wallace, W. E.; Craig, R. S. Hydrogen solubility in 1:5 compounds between yttrium or thorium and nickel or cobalt. Inorganic Chemistry. 1974, 13 (9): 2282–2283. doi:10.1021/ic50139a050.
^
Kirchheim, R.; Mutschele, T.; Kieninger, W.; Gleiter, H.; Birringer, R.; Koble, T. Hydrogen in amorphous and nanocrystalline metals. Materials Science and Engineering. 1988, 99: 457–462. doi:10.1016/0025-5416(88)90377-1.
^
Kirchheim, R. Hydrogen solubility and diffusivity in defective and amorphous metals. Progress in Materials Science. 1988, 32 (4): 262–325. doi:10.1016/0079-6425(88)90010-2.
^ Durgutlu, A. Experimental investigation of the effect of hydrogen in argon as a shielding gas on TIG welding of austenitic stainless steel. Materials & Design. 2003, 25 (1): 19–23. doi:10.1016/j.matdes.2003.07.004.
^ Atomic Hydrogen Welding. Specialty Welds. 2007. (原始内容存档于2011-07-16).
^ Hardy, W. N. From H2 to cryogenic H masers to HiTc superconductors: An unlikely but rewarding path. Physica C: Superconductivity. 2003,. 388–389: 1–6. Bibcode:2003PhyC..388....1H. doi:10.1016/S0921-4534(02)02591-1.
^ Almqvist, Ebbe. History of industrial gases. New York, N.Y.: Kluwer Academic/Plenum Publishers. 2003: 47–56 [2015-05-20]. ISBN 0306472775.
^ Editor of Balloon HQ. The History of Balloons. Balloon HQ. [2016-01-14].
^ Block, M. Hydrogen as Tracer Gas for Leak Detection. 16th WCNDT 2004 (Montreal, Canada: Sensistor Technologies). 2004-09-03 [2008-03-25].
^ Report from the Commission on Dietary Food Additive Intake (PDF). European Union. [2008-02-05].
^ Le Comber, P. G.; Jones, D. I.; Spear, W. E. Hall effect and impurity conduction in substitutionally doped amorphous silicon. Philosophical Magazine. 1977, 35 (5): 1173–1187. Bibcode:1977PMag...35.1173C. doi:10.1080/14786437708232943.
^ Van de Walle, C.G. Hydrogen as a cause of doping in zinc oxide. Physical Review Letters. 2000, 85 (5): 1012–1015. Bibcode:2000PhRvL..85.1012V. PMID 10991462. doi:10.1103/PhysRevLett.85.1012.
^ Janotti, A.; Van De Walle, C.G. Hydrogen multicentre bonds. Nature Materials. 2007, 6 (1): 44–47. Bibcode:2007NatMa...6...44J. PMID 17143265. doi:10.1038/nmat1795.
^ Kilic, C.; Zunger, Alex. n-type doping of oxides by hydrogen. Applied Physics Letters. 2002, 81 (1): 73–75. Bibcode:2002ApPhL..81...73K. doi:10.1063/1.1482783.
^ Peacock, P. W.; Robertson, J. Behavior of hydrogen in high dielectric constant oxide gate insulators. Applied Physics Letters. 2003, 83 (10): 2025–2027. Bibcode:2003ApPhL..83.2025P. doi:10.1063/1.1609245.
^ Reinsch, J.; Katz, A.; Wean, J.; Aprahamian, G.; MacFarland, J. T. The deuterium isotope effect upon the reaction of fatty acyl-CoA dehydrogenase and butyryl-CoA. J. Biol. Chem. 1980, 255 (19): 9093–97. PMID 7410413.
^ Bergeron, K. D. The Death of no-dual-use. Bulletin of the Atomic Scientists (Educational Foundation for Nuclear Science, Inc.). 2004, 60 (1): 15. doi:10.2968/060001004.
^ Quigg, C. T. Tritium Warning. Bulletin of the Atomic Scientists. March 1984, 40 (3): 56–57.
^ International Temperature Scale of 1990 (PDF). Procès-Verbaux du Comité International des Poids et Mesures. 1989: T23–T42 [2008-03-25].
^ 110.0110.1110.2 McCarthy, J. Hydrogen. Stanford University. 1995-12-31 [2008-03-14]. (原始内容存档于2008-03-14).
^ Nuclear Fusion Power. World Nuclear Association. May 2007 [2008-03-16].
^ Chapter 13: Nuclear Energy — Fission and Fusion. Energy Story. California Energy Commission. 2006 [2008-03-14]. (原始内容存档于2008-03-02).
^ DOE Seeks Applicants for Solicitation on the Employment Effects of a Transition to a Hydrogen Economy. Hydrogen Program (新闻稿). US Department of Energy. 2006-03-22 [2008-03-16]. (原始内容存档于2011-07-19).
^ 114.0114.1 Carbon Capture Strategy Could Lead to Emission-Free Cars (新闻稿). Georgia Tech. 2008-02-11 [2008-03-16].
^ Heffel, J. W. NOx emission and performance data for a hydrogen fueled internal combustion engine at 1500 rpm using exhaust gas recirculation. International Journal of Hydrogen Energy. 2002, 28 (8): 901–908. doi:10.1016/S0360-3199(02)00157-X.
^ Garbak, John. VIII.0 Technology Validation Sub-Program Overview (PDF). DOE Fuel Cell Technologies Program, FY 2010 Annual Progress Report. 2011 [2015-05-20].
^ Romm, J. J. The Hype About Hydrogen: Fact And Fiction In The Race To Save The Climate 1st. Island Press. 2004. ISBN 1-55963-703-X.
^ Cammack, R.; Robson, R. L. Hydrogen as a Fuel: Learning from Nature. Taylor & Francis Ltd. 2001: 202–203. ISBN 0-415-24242-8.
^ Rhee, T. S.; Brenninkmeijer, C. A. M.; Röckmann, T. The overwhelming role of soils in the global atmospheric hydrogen cycle. Atmospheric Chemistry and Physics. 2006-05-19, 6 (6): 1611–1625 [2015-05-20]. doi:10.5194/acp-6-1611-2006.
^ Kruse, O.; Rupprecht, J.; Bader, K.; Thomas-Hall, S.; Schenk, P. M.; Finazzi, G.; Hankamer, B. Improved photobiological H2 production in engineered green algal cells. The Journal of Biological Chemistry. 2005, 280 (40): 34170–7. PMID 16100118. doi:10.1074/jbc.M503840200.
^ Smith, Hamilton O.; Xu, Qing. IV.E.6 Hydrogen from Water in a Novel Recombinant Oxygen-Tolerant Cyanobacteria System (PDF). FY2005 Progress Report. United States Department of Energy. 2005 [September 2015].
^ Williams, C. Pond life: the future of energy. Science (The Register). 2006-02-24 [2008-03-24].
^ 123.0123.1 Brown, W. J.; 等. Safety Standard for Hydrogen and Hydrogen Systems (PDF). NASA. 1997 [2008-02-05].
^ Walker, James L.; Waltrip, John S.; Zanker, Adam. John J. McKetta; William Aaron Cunningham, 编. Lactic acid to magnesium supply-demand relationships. Encyclopedia of Chemical Processing and Design 28 (New York: Dekker). 1988: 186 [2015-05-20]. ISBN 082472478X.
^ Liquid Hydrogen MSDS (PDF). Praxair, Inc. September 2004 [2008-04-16]. (原始内容 (PDF)存档于2008-05-27).
^ 'Bugs' and hydrogen embrittlement. Science News (Washington, D.C.). 1985-07-20, 128 (3): 41. JSTOR 3970088. doi:10.2307/3970088.
^ Hayes, B. Union Oil Amine Absorber Tower. TWI. [2010-01-29].
延伸閱讀
| 關於Hydrogen 的圖書館資源 |
|
Chart of the Nuclides 17th. Knolls Atomic Power Laboratory. 2010. ISBN 978-0-9843653-0-2.
Ferreira-Aparicio, P; Benito, M. J.; Sanz, J. L. New Trends in Reforming Technologies: from Hydrogen Industrial Plants to Multifuel Microreformers. Catalysis Reviews. 2005, 47 (4): 491–588. doi:10.1080/01614940500364958.
Newton, David E. The Chemical Elements. New York: Franklin Watts. 1994. ISBN 0-531-12501-7.
Rigden, John S. Hydrogen: The Essential Element. Cambridge, Massachusetts: Harvard University Press. 2002. ISBN 0-531-12501-7.
Romm, Joseph, J. The Hype about Hydrogen, Fact and Fiction in the Race to Save the Climate. Island Press. 2004. ISBN 1-55963-703-X.
Scerri, Eric. The Periodic System, Its Story and Its Significance. New York: Oxford University Press. 2007. ISBN 0-19-530573-6.
外部連結
Basic Hydrogen Calculations of Quantum Mechanics(量子力學有關氫原子的基礎計算)
Hydrogen at The Periodic Table of Videos(諾丁漢大學)
High temperature hydrogen phase diagram(高溫氫相圖)
Wavefunction of hydrogen(氫原子的波函數)
| ||||||
| ||||||||||||||||||||||||||||||||||
元素周期表 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| | IA 1 | IIA 2 | IIIB 3 | IVB 4 | VB 5 | VIB 6 | VIIB 7 | VIIIB 8 | VIIIB 9 | VIIIB 10 | IB 11 | IIB 12 | IIIA 13 | IVA 14 | VA 15 | VIA 16 | VIIA 17 | VIIIA 18 | ||||||||||||||||||
1 | H | | He | |||||||||||||||||||||||||||||||||
2 | Li | Be | | B | C | N | O | F | Ne | |||||||||||||||||||||||||||
3 | Na | Mg | | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||
4 | K | Ca | | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||
5 | Rb | Sr | | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||
6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||
7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||
| ||||||||||||||||||||||||||||||||||||
|
















Comments
Post a Comment