六氟化铂
| 六氟化铂 | |
|---|---|
 | |
IUPAC名 Platinum hexafluoride | |
| 别名 | 氟化铂(VI) |
| 识别 | |
CAS号 | 13693-05-5 |
| 性质 | |
化学式 | PtF6 |
摩尔质量 | 309.1 g·mol⁻¹ |
| 外观 | 暗红色易挥发性的固体 |
密度 | 5.21 g/cm3 |
熔点 | 61.3 °C[1] |
沸点 | 69.1 °C[1] |
| 危险性 | |
| 主要危害 | 氧化性 |
| 相关物质 | |
| 相关化学品 | 六氟合铂酸氙 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
六氟化铂,即氟化铂(VI),是一个深红色的挥发性固体,化学式为PtF6。该化合物中的铂为+6氧化态,只有四个d电子,呈顺磁性,基态时为三线态。
PtF6是很强的氧化剂和氟化剂。最熟知的是它与氙生成"XePtF6"六氟合铂酸氙的反应,后者是第一个制得的稀有气体化合物。此外,六氟化铂也可以氧化氧气,生成含有二氧基(O2+)的化合物“六氟合铂(V)酸二氧基”(O2)+[PtF6]−。
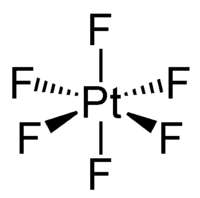
固态和气态六氟化铂都为八面体构型,Pt-F键长185pm。[2]
目录
1 合成
2 其他六氟化物
3 参考资料
4 延伸阅读
合成
PtF6首次由金属铂与氟气化合制备:[3][2]
- Pt + 3 F2 → PtF6
此外六氟化铂也可由PtF5的歧化反应得到。PtF5可由氟化PtCl2制得:
- PtCl2 + 2.5 F2 → PtF5 + Cl2
- 2 PtF5 → PtF6 + PtF4
其他六氟化物
其他元素的六氟化物,如六氟化锇、铱、铑、钌、铼、钨、钼、锝和铀,也具有挥发性,为八面体构型,是强氧化剂。六氟化铀和六氟化钨分别用在核工业和微电子工业中。
主族元素中,硫、氙、硒和碲可生成六氟化物。六氟化硫稳定性很高,用作保护气;六氟化硒和六氟化碲则具有很强的反应性。
参考资料
^ 1.01.1 Perry, Dale L. and Sidney L. Phillips. Handbook of Inorganic Compounds. CRC Press, 1995. ISBN 0849386713. Google Book Search Result
^ 2.02.1 Drews, T.; Supel, J.; Hagenbach, A.; Seppelt, K. “Solid State Molecular Structures of Transition Metal Hexafluorides” Inorganic Chemistry 2006, volume 45, pp 3782-3788.doi:10.1021/ic052029f
^ Weinstock, B.; Claassen, H. H.; Malm, J. G. “Platinum Hexafluoride” Journal of the American Chemical Society 1957, volume 79, pp 5832 - 5832. doi:10.1021/ja01578a073
延伸阅读
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
| |||||||||||||||||||||||||||||

Comments
Post a Comment