高氯酸盐
| 高氯酸盐 | |||
|---|---|---|---|
 | |||
| |||
系统名 Perchlorate[1] | |||
| 识别 | |||
CAS号 | 14797-73-0 | ||
PubChem | 123351 | ||
ChemSpider | 109953 | ||
SMILES |
| ||
Gmelin | 2136 | ||
ChEBI | 49706 | ||
DrugBank | DB03138 | ||
MeSH | 180053 | ||
IUPHAR配体 | 4524 | ||
| 性质 | |||
化学式 | ClO− 4 | ||
摩尔质量 | 99.451 g mol−1 g·mol⁻¹ | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
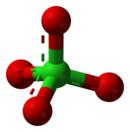
過氯酸盐是過氯酸形成的盐类,含有四面体型的過氯酸根离子—ClO4−,其中氯的氧化态为+7。過氯酸盐存在于自然界中,主要用作火箭燃料和烟火中的氧化剂和安全气囊中的爆炸物。多数過氯酸盐可溶于水。[2]
常见的高氯酸盐有:
高氯酸铵—NH4ClO4,用作固体火箭燃料中的氧化剂
高氯酸铯—CsClO4
高氯酸锂—LiClO4,放热分解放出氧气,用作空间飞船中的生氧剂
高氯酸镁—Mg(ClO4)2
高氯酸钾—KClO4,用于烟火中
高氯酸铷—RbClO4
高氯酸银—AgClO4
高氯酸钠—NaClO4
氧化性
尽管其中氯的氧化态为+7,但在氯的所有含氧酸根离子中,高氯酸根离子的氧化性最弱。这是由于氯在高氯酸根离子中处于四面体的中心,不易发生反应。大多数高氯酸盐,尤其是电正性金属如钠形成的化合物如高氯酸钠,都相对较稳定,也因此可以取代曾经用于烟火中但具不稳定性的氯酸盐类氧化剂。
在溶液中,Ru(II)可以将ClO4-还原为ClO3-,V(II)、V(III)、Mo(III)、二聚Mo(III)、Cr(II)和Ti(III)都可将ClO4-还原为Cl-。[3]
参见
高溴酸盐、高碘酸盐
次氯酸盐、亚氯酸盐、氯酸盐
参考资料
^ Perchlorate - PubChem Public Chemical Database. The PubChem Project. USA: National Center for Biotechnology Information.
^ Draft Toxicological Profile for Perchlorates, Agency for Toxic Substances and Disease Registry, U.S. DEPARTMENT OF HEALTH AND HUMAN SERVICES, September, 2005.
^ Edward T. Urbansky. Perchlorate Chemistry: Implications for Analysis and Remediation, 1998
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


Comments
Post a Comment