呋喃
| 呋喃 | |||
|---|---|---|---|
| |||
 | |||
IUPAC名 Furan | |||
| 别名 | 氧杂茂,1-氧杂-2,4-环戊二烯 | ||
| 识别 | |||
CAS号 | 110-00-9 | ||
PubChem | 8029 | ||
ChemSpider | 7738 | ||
SMILES |
| ||
InChI |
| ||
InChIKey | YLQBMQCUIZJEEH-UHFFFAOYAC | ||
KEGG | C14275 | ||
| 性质 | |||
化学式 | C4H4O | ||
摩尔质量 | 68.07 g·mol⁻¹ | ||
| 外观 | 无色易挥发液体 | ||
密度 | 0.936 g/mL | ||
熔点 | -85.6 °C | ||
沸点 | 31.4 °C | ||
| 危险性 | |||
闪点 | -35 °C | ||
| 相关物质 | |||
| 相关杂环 | 吡咯 噻吩 | ||
| 相关化学品 | 四氢呋喃 (THF) 2,5-二甲基呋喃 苯并呋喃 二苯并呋喃 | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
呋喃(英语:furan)是一种含有一个由四个碳原子和一个氧原子的五元芳环的杂环有机物。含有呋喃环的化合物即為呋喃的同系物。呋喃是一种无色、可燃、易挥发液体,沸点接近于室温。呋喃具有毒性且為2B類可能致癌物質。[1]它常作为合成其他复杂有机物的起始原料。[2]呋喃性质与苯相似,可由松木蒸馏得到,可溶於多種常見的有機溶劑,包括丙酮、醇、醚,微溶於水。為多种重要的工業化學品與藥物的前驅體,如常被作為溶劑使用的四氢呋喃。[3]
目录
1 历史
2 生产
3 化学性质
3.1 鉴定
4 参考文献
5 外部链接
6 参见
历史
“呋喃”的英文单词 furan 来自于拉丁文单词 furfur ,即米糠。[4] 第一个被发现的呋喃衍生物是卡尔·威廉·舍勒于1780年发现的2-糠酸。另一种重要衍生物糠醛,由德贝莱纳于1831年报道。而呋喃本身是在1870年被德国化学家制备成功。[5][6]
生产
工业生产呋喃可由糠醛在钯的催化作用下脱除羰基而得,或在氯化铜水溶液催化下將1,3-丁二烯氧化:[2]
实验室中,制取呋喃可以先将糠醛氧化为呋喃-2-甲酸,再对之脱羧[7]。它也可由戊糖的热分解获得,也包括固体纤维素,尤其是松木。
呋喃的经典合成线路是Feist–Bénary合成。而最简单的合成法之一是帕尔-克诺尔合成,用1,4-二酮与五氧化二磷 (P2O5)反应。另外,通过回收噻吩的合成工艺中, 1,4-二酮和劳森试剂反应所得到的副产品也可以得到呋喃。
化学性质
由于其分子中氧原子的一对孤对电子在共轭轨道平面内形成大Π键,使得共轭平面内共6个电子,符合4n+2規則,所以呋喃具有芳香性(见休克尔规则)。芳香性使得呋喃具有“易取代难加成”的性质。氧的另外一对孤对电子向外伸展。氧原子本身符合sp2杂化。
由于芳环的存在,呋喃的化学行为就与其它不饱和杂环不太相似。
- 芳环中的氧具有给电子效应,所以呋喃的亲电取代反应活性强于苯。共振论对呋喃的研究发现呋喃环上的电子云密度较大,支持了亲电反应活性的理论。[8]

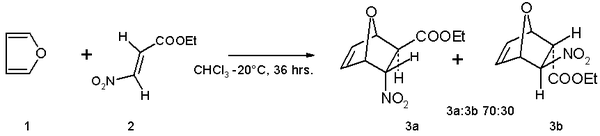
- 呋喃可以作Diels-Alder反应中的双烯体,与缺电子亲双烯体,例如(E)-3-硝基丙烯酸乙酯,发生一个周环反应。得到的产物是Z/E异构体的混合物。(参见顺反异构与E/Z标记)[9]:
- 呋喃的氢化过程中会先产生二氢化呋喃的两种同分异构体(包括1,4-二氢和1,2-二氢),进而产生四氢呋喃。
鉴定
呋喃和被盐酸浸过的松木片作用,松木片会显绿色。[10]
参考文献
^ Bakhiya, Nadiya; Appel, Klaus E. Toxicity and carcinogenicity of furan in human diet. Archives of Toxicology. 2010-07-01, 84 (7): 563–578. ISSN 0340-5761. doi:10.1007/s00204-010-0531-y (英语).
^ 2.02.1 H. E. Hoydonckx, W. M. Van Rhijn, W. Van Rhijn, D. E. De Vos, P. A. Jacobs, Furfural and Derivatives, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a12_119.pub2
^ Junichi Kanetaka, Taisuke Asano, and Shinobu Masamune. New Process for Production of Tetrahydrofuran. Industrial & Engineering Chemistry. 1970, 4 (62): 24-32. doi:10.1021/ie50724a005.
^ Alexander Senning. Elsevier's Dictionary of Chemoetymology. Elsevier, 2006. ISBN 978-0-444-52239-9.
^ Limpricht, H. Ueber das Tetraphenol C4H4O. Berichte der deutschen chemischen Gesellschaft. 1870, 3 (1): pp. 90–91. doi:10.1002/cber.18700030129.
^ Rodd, Ernest Harry. Chemistry of Carbon Compounds: A Modern Comprehensive Treatise. Elsevier. 1971.
^ Wilson, W.C. (1941). "Furan". Org. Synth.; Coll. Vol. 1: 274.
^ Bruice, Paula Y. Organic Chemistry Fifth. Upper Saddle River, NJ: Pearson Prentice Hall. 2007. ISBN 0-13-196316-3.
^ Masesane I, Batsanov A, Howard J, Modal R, Steel P. The oxanorbornene approach to 3-hydroxy, 3,4-dihydroxy and 3,4,5-trihydroxy derivatives of 2-aminocyclohexanecarboxylic acid. Beilstein Journal of Organic Chemistry. 2006, 2 (9): 9. PMC 1524792. PMID 16674802. doi:10.1186/1860-5397-2-9.
^ 谷亨杰 等. 有机化学(第二版). 高等教育出版社, 2000.7. pp 381. 吡咯、呋喃和噻吩的鉴定
外部链接
- Recent synthetic methods
参见
- 杂环
- 呋喃糖
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|




Comments
Post a Comment