氯仿
| 氯仿 | |||
|---|---|---|---|
| |||
| |||
IUPAC名 Trichloromethane | |||
| 别名 | 三氯甲烷、三氯化碳、哥罗芳 | ||
| 识别 | |||
CAS号 | 67-66-3 | ||
PubChem | 6212 | ||
ChemSpider | 5977 | ||
SMILES |
| ||
InChI |
| ||
InChIKey | HEDRZPFGACZZDS-UHFFFAOYAG | ||
EINECS | 200-663-8 | ||
ChEBI | 35255 | ||
RTECS | FS9100000 | ||
KEGG | C13827 | ||
| 性质 | |||
化学式 | CHCl3 | ||
摩尔质量 | 119.38 g·mol⁻¹ | ||
| 外观 | 无色液体 | ||
密度 | 1.48 g/cm³(液) | ||
熔点 | -63.5 °C | ||
沸点 | 61.2 °C | ||
溶解性(水) | 0.8 g/100 ml, 20 °C | ||
折光度n D | 1.4459 | ||
| 结构 | |||
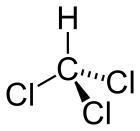
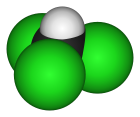
分子构型 | 四面体 | ||
| 危险性 | |||
欧盟危险性符号  有害 Xn 有害 Xn 刺激性 Xi 刺激性 Xi | |||
警示术语 | R:R22-R38-R40-R48/20/22 | ||
安全术语 | S:S2-S36/37 | ||
欧盟分类 | 有害 (Xn) 刺激性 (Xi) Carc. Cat. 2B | ||
NFPA 704 |  0 2 0 | ||
闪点 | 不可燃 | ||
PEL | 50 ppm (240 mg/m3) (OSHA) | ||
| 相关物质 | |||
| 其他阴离子 | 碘仿、溴仿、氟仿 | ||
| 相关化学品 | 二氯甲烷、一氯甲烷 四氯化碳 | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
三氯甲烷(英语:chloroform)俗稱氯仿,又称哥罗芳,分子式CHCl3,分子量119.38。“氯仿”一名为英文名的音譯兼意譯;“哥罗芳”为音译。氯仿在常温下为无色、有气味的液体,是生产聚四氟乙烯的原料;也曾用作制冷剂,现已被淘汰[1]。
目录
1 合成方法
1.1 氘代氯仿的合成方法
1.2 氯仿的工业生产
2 用途
2.1 麻醉剂
2.2 溶剂
2.3 作为试剂应用于有机合成
3 安全
4 注意
5 参考资料
6 外部链接
合成方法
氯仿的人工合成方法是由三个研究者各自独立发现的。1831年法国化学家Eugène Soubeiran报道了用丙酮或乙醇与次氯酸钙反应制备氯仿的方法[2],美国物理学家Samuel Guthrie制备出了几加仑的氯仿并描述制备出的产物"deliciousness of flavor"[3],同年李比希也合成并描述了氯仿[4]。1834年法国化学家讓-巴蒂斯特·杜馬对氯仿做了命名和化学性质的鉴定。[5]。
工业上通常可由甲烷和氯气进行取代反应制得。在实验室制备少量氯仿时,纯度要求不高的话,也可透过乙醇或丙酮和氯漂白剂混合反应制得,光照(紫外线)可提高反应速率。
氘代氯仿的合成方法
氘代氯仿是氯仿的同位素体(Isotopologue),氯仿分子中的氢原子被它的同位素氘原子替代。氘代氯仿是一种常用的核磁共振用溶剂,可通过氘代氢氧化钠与氯仿反应得到[6]。
氯仿的工业生产
工业上大量生产氯仿是通过加热氯气和甲烷或一氯甲烷的混合物得到的[1],在400–500 °C的条件下发生自由基卤代反应:
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
氯仿被进一步氯代能得到四氯化碳
:CHCl3 + Cl2 → CCl4 + HCl
因此通过加热氯气和甲烷或一氯甲烷的混合物这个过程得到的是四种氯代甲烷的混合物,通过蒸馏分离得到氯仿[1]。
用途
氯仿的主要用途是合成二氟一氯甲烷(R-22),二氟一氯甲烷是生产聚四氟乙烯所用的单体四氟乙烯的原料
- CHCl3+2HF →30−80oC, 392.25−588.39kPaSbCl5 CHClF2+2HCl{displaystyle mathrm { CHCl_{3}+2HF {xrightarrow[{30!-!80^{o}C, 392.25!-!588.39kPa}]{SbCl_{5}}} CHClF_{2}+2HCl} }
麻醉剂
曾作为麻醉剂被广泛使用,这个用途是在1847年11月4日由苏格兰妇产科医生詹姆斯·楊·辛普森和他的朋友们在他们自己身上做试验以寻找一种可代替乙醚的物质作为全身麻醉剂(General anesthetics)的过程中所发现的[7][8],随后在外科手术中使用氯仿做麻醉剂的方法迅速在欧洲各地传播开来,19世纪50年代在维多利亚女王最后两个孩子的出生过程中医生约翰·斯诺用到了氯仿作为麻醉剂[9]。氯仿也可为作镇静剂用。
溶剂
氯仿由于其相对化学惰性、能与大多数有机液体混溶和易挥发的特点,成为实验室的常用溶剂。它作为溶剂在药物工业中使用也用于生产染料和杀虫剂。它能有效溶解许多游离态的生物碱,所以常在从植物中提取药物成分的过程中作为萃取剂使用,比如它可用于从提取罂粟目植物中提取吗啡和从曼陀罗属植物中提取東莨菪碱。亦能够溶解聚甲基丙烯酸甲酯,故此用于粘接有机玻璃。
作为试剂应用于有机合成
氯仿作为有机合成的原料,可用于制作氟里昂。氯仿在相转移催化剂存在下与氢氧化钠的水溶液反应可产生二氯卡宾(Dichlorocarbene)[10][11][12],产生的二氯卡宾可被烯烃捕获生成环丙烷的衍生物。
安全
由于它会被用作镇静剂,短时间吸入已经会产生晕眩、疲倦、头痛等症状。氯仿也有致癌性。
在学校实验室,如果氯仿浓度不高的话,可用棕色瓶储存(阻隔光線),并加水于其上层以免它气化。实验室中对氯仿进行倾倒时要在通风橱内进行,因为氯仿见光易被氧化生成有毒的光气。
氯仿与丙酮的混合物在碱性环境下会发生剧烈的放热反应,可能有爆炸疑慮。[13]
三氯甲烷对人体有致癌可能,國際癌症研究機構(IARC)目前将氯仿列为2B类致癌物质(有可能对人类致癌)。[14]
注意
氯仿具有一般金木工、手作的用途,能够在五金店之类的地方获得,不法之徒会利用其镇静功效来迷晕受害者。
香港在1990年代发生过与其有关的劫案,当时市民有些「闻哥罗芳色变」。这也只是芸芸「迷晕党」中的其中一种。
参考资料
^ 1.01.11.2 M. Rossberg et al.“Chlorinated Hydrocarbons”in Ullmann’s Encyclopedia of Industrial Chemistry, 2006, Wiley-VCH, Weinheim. doi:10.1002/14356007.a06_233.pub2
^ Eugène Soubeiran. Ann. Chim. 1831, 48: 131. 缺少或|title=为空 (帮助)
^ Samuel Guthrie. New mode of preparing a spirituous solution of Chloric Ether. Am. J. Sci. And Arts. 1832, 21: 64.
^ Justus Liebig. Ueber die Verbindungen, welche durch die Einwirkung des Chlors auf Alkohol, Aether, ölbildendes Gas und Essiggeist entstehen. Annalen der Pharmacie. 1832, 1 (2): 182–230. doi:10.1002/jlac.18320010203.
^ Jean-Baptiste Dumas. Untersuchung über die Wirkung des Chlors auf den Alkohol. Annalen der Pharmacie. 1834, 107 (41): 650–656. doi:10.1002/andp.18341074103.
^ Canadian Patent 1085423[永久失效連結]
^ Gordon, H. Laing. Sir James Young Simpson and Chloroform (1811-1870). The Minerva Group, Inc. 2002-11: 106–109 [11 November 2011]. ISBN 978-1-4102-0291-8.
^ 陳炳聖. 《萬物簡史》. 源樺. 2007. ISBN 986828421X.
^ Anesthesia and Queen Victoria
^ Srebnik, M.; Laloë, E. "Chloroform" Encyclopedia of Reagents for Organic Synthesis" 2001 John Wiley.doi:10.1002/047084289X.rc105
^ (1988) "1,6-Methano[10]annulene". Org. Synth.; Coll. Vol. 6: 731.
^ Gokel, G. W.; Widera, R. P.; Weber, W. P. (1988). "Phase-Transfer Hofmann Carbylamine Reaction: tert-Butyl Isocyanide". Org. Synth.; Coll. Vol. 6: 232.
^ Acetone (ICSC)
^ IARC Summaries & Evaluations VOL. 73 (1999) (p. 131)
外部链接
Chloroform "The Molecular Lifesaver" 牛津大学的Stephen Belding创作的一篇介绍氯仿性质和用途的文章- Concise International Chemical Assessment Document 58
- IARC Summaries & Evaluations: Vol. 1 (1972), Vol. 20 (1979), Suppl. 7 (1987), Vol. 73 (1999)
- 国际化学品安全卡0027
NIOSH Pocket Guide to Chemical Hazards 0127
- National Pollutant Inventory - Chloroform and trichloromethane
- NIST Standard Reference Database
Story on Chloroform from BBC's The Material World (28 July 2005)
Sudden Sniffer's Death Syndrome article at Carolinas Poison Center- Calculation of vapor pressure, liquid density, dynamic liquid viscosity, surface tension of chloroform
- ChemSub Online: Chloroform - Methane, trichloro-
| ||||||||||||||||||||||
|


![{mathrm { CHCl_{3}+2HF {xrightarrow[ {30!-!80^{o}C, 392.25!-!588.39kPa}]{SbCl_{5}}} CHClF_{2}+2HCl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/940cc6ad7cb3b1a878ef64a9a0fccb3d99d41df3)
Comments
Post a Comment