16S 核糖体RNA

嗜热栖热菌(Thermus thermophilus)的30S亚基的三维分子结构图。分子中的淡蓝色部分为蛋白质,淡橙色部分为RNA单链。[1]
16S核糖体RNA(16S ribosomal RNA),简称16S rRNA,是原核生物的核糖体中30S亚基的组成部分。16S rRNA的长度约为1,542 nt。卡尔·乌斯和乔治·福克斯是率先在系统发育中使用的16S rRNA基因的两个先驱者[2]。
一个细菌的细胞中可包含多个具有不同序列的16S rRNA[3]。
目录
1 功能
2 结构
3 通用引物
3.1 PCR中的应用
4 16S核糖体数据库
5 参考文献
6 外部链接
功能
已知16S rRNA具有如下几项功能:
- 16S rRNA具有与原核生物核糖体大亚基中的23S rRNA相似的结构决定功能,可作为核糖体蛋白质结合的架构。在足量Mg2+存在下分离到的16S rRNA处于紧密状态,其空间结构与30S亚基的大小和形状十分相似。[4]
- 16S rRNA的3'端含有能与mRNA上游AUG起始密码子通过氢键结合的反夏因-达尔加诺序列。另有发现表明,16S rRNA中1,505-1,539的CCUCC序列与mRNA的相应序列有互补关系。[4]
- 16S rRNA能通过氢键与23S rRNA结合,增强原核生物70S核糖体一大一小两个亚基(50S亚基与30S亚基)结合时的稳定性。
- 16S rRNA能通过其1,492及1,493的腺嘌呤残基(参见嘌呤分子结构图解)的N1原子与mRNA骨架上的2'OH基团之间产生氢键,使核糖体A位密码子-反密码子的碱基互补配对稳定化。
结构
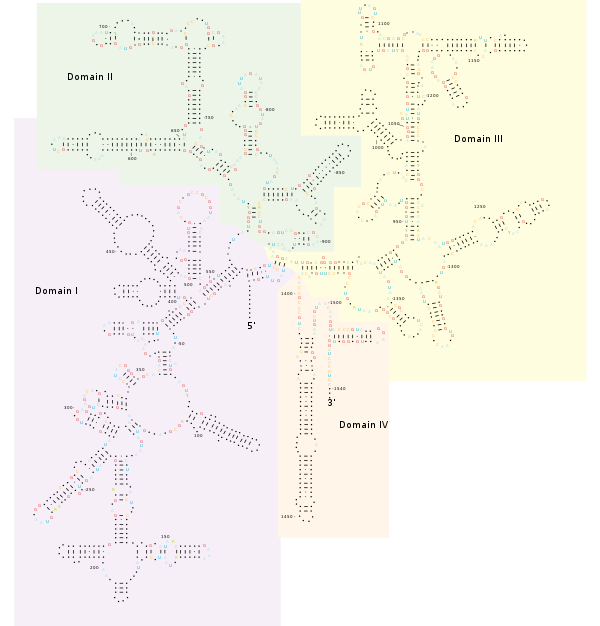
通用引物
由于不同种的真细菌与古细菌间的16S rRNA基因(16S rDNA)是高度保守的[5],16S rDNA常被用于对各种生物进行的系统发生学方面的研究[6]这种运用16S rRNA对生物进行系统发生学研究的方法由卡尔·沃斯(Carl Woese)开创[7]。另外,线粒体和叶绿体中的rRNA也都被扩增了。在获得能提供系统发育学信息的16S rRNA分子时需要利用通用PCR引物对16S rRNA分子进行扩增。16S rRNA序列的对比分析需要在这类“通用引物”的脱氧核糖核酸分子的辅助下完成,这类分子具有如下序列:
- 8UA正向:5'-AGA GTT TGA TCM TGG CTC AG-3'
- 519B反向:5'-GTA TTA CCG CGG CKG CTG-3'
- 反向:ACG GCT ACC TTG TTA CGA CTT
这类引物因并未在近期发现的几种属于纳古菌门(Nanoarchaeota)的热液古菌[8]中分离识别出来,也被称为准通用引物。
| 引物名字 | 序列 (5'-3') | 参考资料 |
|---|---|---|
| 8F | AGA GTT TGA TCC TGG CTC AG | [9][10] |
| U1492R | GGT TAC CTT GTT ACG ACT T | 同上 |
| 928F | TAA AAC TYA AAK GAA TTG ACG GG | [11] |
| 336R | ACT GCT GCS YCC CGT AGG AGT CT | 同上 |
| 1100F | YAA CGA GCG CAA CCC | |
| 1100R | GGG TTG CGC TCG TTG | |
| 337F | GAC TCC TAC GGG AGG CWG CAG | |
| 907R | CCG TCA ATT CCT TTR AGT TT | |
| 785F | GGA TTA GAT ACC CTG GTA | |
| 805R | GAC TAC CAG GGT ATC TAA TC | |
| 533F | GTG CCA GCM GCC GCG GTA A | |
| 518R | GTA TTA CCG CGG CTG CTG G | |
| 27F | AGA GTT TGA TCM TGG CTC AG | [12] |
| 1492R | CGG TTA CCT TGT TAC GAC TT | 同上 |
PCR中的应用
除了高度保守的引物结合位点之外,16S核糖体RNA基因序列包含高变区,可以提供具体物种的签名序列用于鉴定细菌的有用的[13][14]。其结果是,16S核糖体RNA基因测序已经成为医学微生物学普遍的作为一种快速和廉价的鉴定细菌表型方法的替代方法[15]。尽管它最初用于鉴定细菌,随后16S测序被发现能够重新分类细菌进入完全新的物种[16],或者甚至是属[17][18]。它还已经被用于描述具有从未被成功培养的新物种[19][20]。
16S核糖体数据库
因为它存在于大多数微生物并显示适当的变化,16S rRNA基因被用作分类鉴定微生物的标准。大多数细菌和古细菌的16S rRNA基因序列型菌株可在公共数据库得到,例如NCBI数据库。然而,在这些数据库中发现的序列的质量往往没有验证。因此,只收集16S rRNA序列辅助数据库被广泛使用。最经常使用的数据库如下:
1) EzTaxon-e. https://web.archive.org/web/20130928154318/http://eztaxon-e.ezbiocloud.net/ [21]
2)核糖体数据库项目。http://rdp.cme.msu.edu/ 核糖体数据库项目(RDP)。
3) SILVA. [22]
4) Greengenes. Greengenes是基于新生系统发生,提供了标准的操作分类单元集的质量控制,全面的16S参考数据库和分类。该网站的官方主页是http://greengenes.secondgenome.com,并在Creative[失效連結] Commons许可BY-SA3.0许可[23][24]。
参考文献
^ Schluenzen F, Tocilj A, Zarivach R, Harms J, Gluehmann M, Janell D, Bashan A, Bartels H, Agmon I, Franceschi F, Yonath A 在3.3 Å解析度下具有功能活性的核糖体小亚基. Structure of functionally activated small ribosomal subunit at 3.3 angstroms resolution. Cell. 2000, 102 (5): 615–23. PMID 11007480. doi:10.1016/S0092-8674(00)00084-2.
^ Woese, Carl R.; Kandler, O; Wheelis, M. Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya. Proc Natl Acad Sci USA. 1990, 87 (12): 4576–9. Bibcode:1990PNAS...87.4576W. PMC 54159. PMID 2112744. doi:10.1073/pnas.87.12.4576.
^ Case RJ, Boucher Y, Dahllöf I, Holmström C, Doolittle WF, Kjelleberg S. Use of 16S rRNA and rpoB genes as molecular markers for microbial ecology studies. Appl. Environ. Microbiol. January 2007, 73 (1): 278–88. PMC 1797146. PMID 17071787. doi:10.1128/AEM.01177-06.
^ 4.04.1 聂剑初、吴国利、张翼伸、杨绍钟、刘鸿铭. 生物化学简明教程. 北京: 高等教育出版社. 1996年6月(2002年重印): 59. ISBN 7-04-007259-9. 请检查|date=中的日期值 (帮助); 使用|accessdate=需要含有|url=(帮助)
^ Coenye T, Vandamme P. 在已测序细菌基因组中的多种16S rRNA操纵子的基因内接合的不均一性. FEMS Microbiol. Lett. November 2003, 228 (1): 45–9. PMID 14612235. doi:10.1016/S0378-1097(03)00717-1.
^ 系统发育学研究中对16S rDNA扩增的运用W G Weisburg, S M Barns, D A Pelletier and D J Lane; J Bacteriol. 1991 January; 173(2): 697-703
^ Woese, C. R.; Fox, G. E. Phylogenetic structure of the prokaryotic domain: The primary kingdoms. Proceedings of the National Academy of Sciences (Proceedings of the National Academy of Sciences). 1977-11-01, 74 (11): 5088–5090. ISSN 0027-8424. doi:10.1073/pnas.74.11.5088.
^ Huber H, Hohn MJ, Rachel R, Fuchs T, Wimmer VC, Stetter KO. 一个新发现的由一个纳米嗜热古菌的共生体代表的古菌门. Nature. 2002, 417 (6884): 63–7. PMID 11986665. doi:10.1038/417063a.
^ Eden PA, Schmidt TM, Blakemore RP, Pace NR. Phylogenetic Analysis of Aquaspirillum magnetotacticum Using Polymerase Chain Reaction-Amplified 16S rRNA-Specific DNA. Int J Syst Bacteriol. 1991, 41 (2): 324–325. PMID 1854644. doi:10.1099/00207713-41-2-324.
^ Universal Bacterial Identification by PCR and DNA Sequencing of 16S rRNA Gene. PCR for Clinical Microbiology, 2010, Part 3, 209-214
^ Weidner S, Arnold W, Pühler A. Diversity of uncultured microorganisms associated with the seagrass Halophila stipulacea estimated by restriction fragment length polymorphism analysis of PCR-amplified 16S rRNA genes (PDF). Appl Env Microbiol. 1996, 62 (3): 766–71.
^ Jiang, H.; Dong, H.; Zhang, G.; Yu, B.; Chapman, L. R.; Fields, M. W. Microbial Diversity in Water and Sediment of Lake Chaka, an Athalassohaline Lake in Northwestern China. Applied and Environmental Microbiology. 2006, 72 (6): 3832–3845. PMC 1489620. PMID 16751487. doi:10.1128/AEM.02869-05.
^ Pereira, F.; Carneiro, J.; Matthiesen, R.; van Asch, B.; Pinto, N.; Gusmao, L.; Amorim, A. Identification of species by multiplex analysis of variable-length sequences. Nucleic Acids Research. 4 October 2010, 38 (22): e203–e203. doi:10.1093/nar/gkq865.
^ Kolbert, CP; Persing, DH. Ribosomal DNA sequencing as a tool for identification of bacterial pathogens. Current Opinion in Microbiology. June 1999, 2 (3): 299–305. PMID 10383862. doi:10.1016/S1369-5274(99)80052-6.
^ J. E. Clarridge III. Impact of 16S rRNA gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases. Clin Microbiol Rev. 2004, 17 (4): 840–862. PMC 523561. PMID 15489351. doi:10.1128/CMR.17.4.840-862.2004.
^ Ting Lu, Peter G. Stroot, Daniel B. Oerther. Reverse Transcription of 16S rRNA To Monitor Ribosome-Synthesizing Bacterial Populations in the Environment. Appl Environ Microbiol. 2009, 75 (13): 4589–4598. PMC 2704851. PMID 19395563. doi:10.1128/AEM.02970-08.
^ Weisburg WG, Barns SM, Pelletier DA, Lane DJ. 16S ribosomal DNA amplification for phylogenetic study. J Bacteriol. 1991, 173 (2): 697–703. PMC 207061. PMID 1987160.
^ Brett P J, DeShazer D, Woods DE. Burkholderia thailandensis sp. nov., a Burkholderia pseudomallei-like species. Int J Syst Bacteriol. 1998, 48 (1): 317–320. PMID 9542103. doi:10.1099/00207713-48-1-317.
^ Schmidt TM, Relman DA. Phylogenetic identification of uncultured pathogens using ribosomal RNA sequences. Methods Enzymol. Methods in Enzymology. 1994, 235: 205–22. ISBN 978-0-12-182136-4. PMID 7520119. doi:10.1016/0076-6879(94)35142-2.
^ Gray JP, Herwig RP. Phylogenetic analysis of the bacterial communities in marine sediments. Appl Environ Microbiol. 1996, 62 (11): 4049–59. PMC 168226. PMID 8899989.
^ Chun, J.; Lee, J.-H.; Jung, Y.; Kim, M.; Kim, S.; Kim, B. K.; Lim, Y. W. EzTaxon: a web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences. Int J Syst Evol Microbiol. 2007, 57: 2259–2261. doi:10.1099/ijs.0.64915-0.
^ Elmar Pruesse, Christian Quast, Katrin Knittel, Bernhard M. Fuchs, Wolfgang Ludwig, Jörg Peplies, Frank Oliver Glöckner (2007) Nucleic Acids Res. SILVA: a comprehensive online resource for quality checked and aligned ribosomal RNA sequence data compatible with ARB. December; 35(21): 7188–7196.
^ DeSantis, T. Z.; Hugenholtz, P.; Larsen, N.; Rojas, M.; Brodie, E. L.; Keller, K.; Huber, T.; Dalevi, D.; Hu, P.; Andersen, G. L. Greengenes, a Chimera-Checked 16S rRNA Gene Database and Workbench Compatible with ARB. Appl Environ Microbiol. 2006, 72: 5069–72. doi:10.1128/aem.03006-05.
^ McDonald, D; Price, MN; Goodrich, J; Nawrocki, EP; DeSantis, TZ; Probst, A; Andersen, GL; Knight, R; Hugenholtz, P. An improved Greengenes taxonomy with explicit ranks for ecological and evolutionary analyses of bacteria and archaea. ISME. 2011, 6: 610–618. doi:10.1038/ismej.2011.139.
外部链接
(英文)University of Washington Laboratory Medicine: Molecular Diagnosis | Bacterial Sequencing
(英文)核糖体数据库计划
(英文)核糖体
(英文)SILVA数据库
(英文)greengenes数据库
(英文)eztaxon-e数据库
| ||||||||||||||||||||||||||||||

Comments
Post a Comment