铷
body.skin-minerva .mw-parser-output table.infobox caption{text-align:center}
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外觀 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
灰白色  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 铷(Rubidium)·Rb·37 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 碱金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
族·週期·區 | 1 ·5·s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 85.4678(3) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | [氪] 5s1 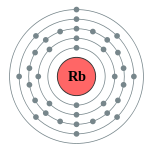 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 發現 | 罗伯特·威廉·本生和古斯塔夫·基尔霍夫(1861年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分離 | 乔治·德海韦西 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 固体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 1.532 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
熔點時液體密度 | 1.46 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | 312.46 K,39.31 °C,102.76 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 961 K,688 °C,1270 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 臨界點 | 2093(預測)[1] K,16 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | 2.19 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | 75.77 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | 31.060 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸氣壓
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | +1 (強鹼性氧化物) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | 0.82(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:403 kJ·mol−1 (更多) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半徑 | 248 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | 220±9 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德華半徑 | 303 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 體心立方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 顺磁性[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電阻率 | (20 °C)128 n Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 58.2 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
聲速(細棒) | (20 °C)1300 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 楊氏模量 | 2.4 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 體積模量 | 2.5 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 0.3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 0.216 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 7440-17-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:铷的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
銣是一種化學元素,符號為Rb,原子序数為37。銣是種質軟、呈銀白色的金屬,屬於鹼金屬,原子量為85.4678。單質銣的反應性極高,其性質與其他鹼金屬相似,例如會在空氣中快速氧化。自然出現的銣元素由兩種同位素組成:85Rb是唯一一種穩定同位素,佔72%;87Rb具微放射性,佔28%,其半衰期為490億年,超過宇宙年齡的三倍。
德國化學家羅伯特·威廉·本生和古斯塔夫·基爾霍夫於1861年利用當時的新技術火焰光譜法發現了銣元素。
銣化合物有一些化學和電子上的應用。銣金屬能夠輕易氣化,而且它有特殊的吸收光譜範圍,所以常被用在原子的激光操控技術上。
銣並沒有已知的生物功用。但生物體對銣離子的處理機制和鉀離子相似,因此銣離子會被主動運輸到植物和動物細胞中。
目录
1 歷史
2 性質
2.1 化合物
2.2 同位素
2.3 存量
3 生產
4 應用
5 安全
6 參考資料
7 延伸閱讀
8 外部連結
歷史

古斯塔夫·基爾霍夫(左)和羅伯特·威廉·本生(中)通過光譜法發現了銣元素。
1861年,羅伯特·威廉·本生和古斯塔夫·基爾霍夫在德國海德堡,利用光譜儀在鋰雲母中發現了銣元素。由於其發射光譜呈現出多條鮮明的紅線,所以他們選擇了拉丁文中意為「深紅色」的「rubidus」一詞為它命名。[3][4]
銣是鋰雲母中的一種次要成分。基爾霍夫和本生所處理的150公斤鋰雲母中,只含有0.24%的氧化銣(Rb2O)。鉀和銣都會和氯鉑酸形成不可溶鹽,但在熱水中,兩種鹽的可溶性有小許差異。可溶性稍低的六氯鉑酸銣(Rb2PtCl6)可以經分級結晶的方法取得。用氫對六氯鉑酸銣進行還原後,基爾霍夫和本生獲得了0.51克的氯化銣。兩人之後對銣和銫進行的首次大型萃取工序用到了4萬4千升礦物水,並一共提取出7.3克氯化銫和9.2克氯化銣。[3][4]基爾霍夫和本生在發明光譜儀僅僅一年後就發現了銣元素。銣因此成為繼銫以後第二個通過光譜學方法發現的元素。[5]
兩人用提取出的氯化銣來估計銣的原子量,得出的數值為85.36(目前受認可的數值為85.47)。[3]他們試圖對熔融氯化銣進行電解以取得單質銣,但他們取得了一種藍色的均勻物質,且「無論在肉眼還是顯微鏡下都無法看出絲毫的金屬成分」。他們推測這種物質是低價氯化銣(Rb2Cl),不過它其實更可能是銣金屬和氯化銣的膠體狀混合物。[6]之後,本生進行了第二次嘗試,對炭化了的酒石酸銣加熱,成功還原了銣金屬。儘管蒸餾出的銣會在空氣中自燃,但本生仍能夠測量出銣的密度和熔點。1860年代所取得的密度值,與今天認可的數值只相差0.1 g/cm3,熔點值的偏差也在1 °C以內。[7]
科學家在1908年發現了銣的微放射性,但同位素理論在1910年代才被建立起來,加上放射性銣的半衰期超過1010年,所以當時對這一現象的解釋尤為困難。有關銣的衰變方式的爭論一直持續到1940年代末。目前已證實,87Rb會經β衰變成為穩定的87Sr。[8][9]
1920年代以前,銣還沒有工業用途。[10]此後,銣的最大應用在於化學和電子範疇的研究和開發。1995年,埃里克·康奈爾、卡爾·埃德溫·威曼和沃爾夫岡·克特勒用銣-87實現了玻色–愛因斯坦凝聚,[11]並因此獲得了2001年的諾貝爾物理學獎。[12]
性質
銣是一種質軟、可塑性高的銀白色金屬。[13]在所有非放射性鹼金屬元素中,銣的電負性排行第二。其熔點為39.3 °C。銣金屬會在水中劇烈反應,它會和汞產生汞齊,並且會和金、鐵、銫、鈉和鉀形成合金(但不會和鋰形成合金,儘管鋰和銣同屬鹼金屬)。這些屬性都和其他的鹼金屬相似。[14]與反應性稍低的鉀和反應性稍高的銫一樣,銣和水所產生的劇烈反應通常足以燃起所釋放出來的氫氣。它也可以在空氣中自燃。[13]銣的電離能很低,只有406 kJ/mol。[15]銣在焰色測試中會發出紫色,和鉀非常相似,所以要用到光譜學技術才能將兩者分辨開來。[來源請求]
化合物

Rb9O2原子簇
氯化銣(RbCl)是最常用的銣化合物之一。在生物化學中,它可以用來促使細胞吸取DNA。由於生物體內的銣極少,且銣會被活細胞吸收而代替鉀,所以它能用作一種生物標記物。氫氧化銣(RbOH)具有腐蝕性,能作為大部份用到銣的化學反應的初始化合物。其他銣化合物還包括用在某些眼鏡鏡片中的碳酸銣(Rb2CO3),以及硫酸銣銅(Rb2SO4·CuSO4·6H2O)等。碘化銣銀(RbAg4I5)是所有已知離子晶體中,室溫電導率最高的。在製造薄膜電池時可以利用這一屬性。[16][17]
銣的氧化物有若干種,包括氧化銣(Rb2O)、Rb6O和Rb9O2,后两种低氧化物可以在空气中燃烧。銣暴露在空氣中即會產生這些氧化物。在氧氣過剩的環境下,則會形成超氧化物(RbO2)。銣和鹵化物形成鹽,例如氟化銣、氯化銣、溴化銣及碘化銣等。[18]
同位素
雖然銣是一種單一同位素元素(即只有一種穩定同位素),但自然界中的銣元素卻由兩種同位素組成:穩定的85Rb(佔72.2%)以及放射性同位素87Rb(佔27.8%)。[19]因此自然界中的銣具有放射性,比活性約為670 Bq/g。這樣的輻射水平可以在110天內於照相底片上留下影像。[20][21]除85Rb和87Rb之外,還有30種非自然生成的同位素。它們具有放射性,半衰期都在3個月以內。[22]
銣-87的半衰期為48.8×109年,這是宇宙年齡13.798×109年的三倍有餘。[23]它是一種原生核素,在地球形成時便已存在。在礦物中,銣常會代替鉀元素的位置,所以其分佈廣泛。87Rb在釋放一個負β粒子之後,會衰變成穩定的87Sr,這可以用於測定岩石的年齡。在地球內部的分級結晶過程中,鍶會集中在斜長石中,留下處於液態的銣。因此,在殘餘岩漿中銣對鍶的比例會隨時間增加,經活成分異作用形成銣/鍶比例較高的岩石。偉晶岩中的銣/鍶比例最高(10以上)。如果可以測得或推算出最初的鍶含量,那麼通過測量目前銣和鍶的含量以及87Sr/86Sr比例,就可以算出該岩石樣本的年齡。這一年齡只有在岩石不曾受變動的情況下才等於真實的年齡值。[24][25]
銣-82是其中一種人造同位素,可經鍶-82的電子捕獲衰變過程產生,反應的半衰期為25.36年。銣-82會再經正電子發射衰變為穩定的氪-82,半衰期為76秒。[19]
存量
銣在地球地殼中的豐度在所有元素中排第23位,與鋅相近,比銅更常見。[26]它自然出現在白榴石、銫榴石、光鹵石和鐵鋰雲母等礦物之中,氧化銣大約佔這些礦物的1%。鋰雲母中的銣含量在0.3%和3.5%之間,是銣的主要商業來源。[27]某些含鉀礦物和氯化鉀都會含有不少的銣元素,有商業開採價值。[28]
銣在海水中的濃度平均為125 µg/L。相比之下,鉀的濃度則高得多(408 mg/L),銫則低得多(0.3 µg/L)。[29]
由於離子半徑較大,所以銣屬於所謂的「不相容成分」。[30]在熔岩結晶過程中,銣和更重的同族元素銫聚集在一起,處於液態,是最後一個結晶的成分。因此,含有銣和銫的最大礦藏,都是經由這種濃縮過程所形成的偉晶岩礦帶。由於銣會在結晶時代替鉀的位置,所以其濃縮的程度遠低於銫。從含有銫榴石的偉晶岩中可開採出銫,從鋰雲母中可開採出鋰,過程中也會產生銣作副產品。[26]
銣的主要礦藏包括:位於加拿大曼尼托巴省伯尼克湖的銫榴石礦藏,以及意大利厄爾巴島上的銣長石((Rb,K)AlSi3O8)礦藏,其銣含量高達17.5%。[31]以上兩處同時也是銫的來源。[來源請求]
生產
雖然銣在地殼中比銫更常見,但其應用不廣,加上缺乏一種富含銣的礦物,所以各種銣化合物的年產量只有2至4噸。[26]分離鉀、銣和銫的方法有若干種。對銣礬和銫礬重複進行分級結晶,30次以後便可獲得純銣礬。另外兩種方法分別利用氯錫酸鹽和亞鐵氫化物。[26][32]
1950至1960年代,鉀生產過程中一種稱為「Alkarb」的副產品曾經是銣元素的主要來源。Alkarb含21%的銣,其餘大部份是鉀,另有少量銫。[33]如今,銣是銫開採過程中的一种副產品,加拿大曼尼托巴省的銫榴石礦就是其中一例。[26]

銣的焰色測試
應用

在美國海軍天文台的銣噴泉原子鐘。
銣化合物有時會被添加在煙花當中,使它發出紫光。[34]銣可以用在磁流體發動機和熱傳導發電機中:高溫下形成的銣離子經過磁場,[35]作用就像發電機中的電樞,因而產生電流。用它製成的激光二極體價廉,且激光波長範圍適宜,維持高蒸氣壓所需的溫度也在中等範圍內,所以銣(特別是87Rb)是激光冷卻和玻色–愛因斯坦凝聚應用上最常用的一種原子。[36][37]
科學家曾用銣對3He進行極化,這樣產生的3He氣體擁有單一方向,而不是隨機方向的核自旋。激光對銣氣體進行光抽運,極化了的銣就會通過超精細交互作用使3He極化。[38]這樣自旋極化了的3He氣體可以用在中子極化測量中,或用於製造極化中子作其他用途。[39]
原子鐘的共振元件可以利用銣的能級的超精細結構,因此銣已被應用在高精度計時上。全球定位系統(GPS)常利用銣頻率標準來生成一個比銫頻率標準更精准、成本更低的「主頻率標準」。[40][41]這種銣頻率標準在電信工業中有大規模的生產。[42]
銣的其他潛在應用包括:蒸汽渦輪中的工作流體、真空管中的吸氣劑以及光度感應器元件等。[43]銣是一些特殊玻璃的成分,也可用於製造超氧化物。它能夠在細胞中代替鉀的位置,所以能被用來研究離子通道。銣氣體還被用於原子磁強計中。[44]科學家正在用87Rb,連同其他鹼金屬,來開發無自旋交換弛豫(SERF)原子磁強計。[44]
銣-82可用於正電子發射電腦斷層掃描。銣和鉀相似,所以含有大量鉀的生物組織也會積聚具放射性的銣元素。這一原理主要應用在心肌灌注成像。銣-82的半衰期只有76秒,所以必須從靠近病人的鍶-82衰變而得。[45]由於腦腫瘤的血腦屏障有所變異,所以腫瘤會比正常腦組織更容易積累銣。核醫學可以利用這一原理對腫瘤進行定位和照相。[46]
科學家曾做過實驗,以研究銣對患有躁鬱症和抑鬱症的病人有何影響。[47][48]透析治療期間患上抑鬱症的病人體內缺少銣,所以補充銣元素可能可以舒緩抑鬱症。[49]在某些試驗中,病人須連續60天攝入720 mg的氯化銣。[50][51]
安全
銣金屬會和水發生劇烈的反應,甚至會著火;即使放在煤油中,也会缓慢反应,并被溶解的少量氧给氧化。因此,铷一般保存在真空安瓿或充有稀有气体(如氩气)的安瓿中。只要接觸到少許的空氣,包括滲入油中的氧氣,銣就會變成過氧化銣。因此它的安全措施和鉀金屬相似。[52]
與鈉和鉀一樣,銣溶在水中的時候幾乎永遠呈+1氧化態,在所有生物體內的銣也一樣。Rb+離子在人的體內似乎和鉀離子無異,所以主要積聚在細胞內液中。[53]銣離子並沒有明顯的毒性:一個70公斤重的人體內平均含有0.36克的銣,而在這一數值提升50甚至100倍之後,也沒有對試驗對象造成任何明顯的負面影響。[54]銣在人體內的生物半衰期為31至46天。[47]在老鼠身上進行的實驗指出,如果體內一小部份鉀替換成銣,身體是能夠承受的,但一旦肌肉組織內一半的鉀都換成銣,老鼠便會死亡。[55][56]
參考資料
^ Haynes, William M. (编). CRC Handbook of Chemistry and Physics 92nd. Boca Raton, FL: CRC Press. 2011: 4.122. ISBN 1439855110.
^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存檔,存档日期2012-01-12., in Handbook of Chemistry and Physics 81st edition, CRC press.
^ 3.03.13.2 Kirchhoff,, G.; Bunsen, R. Chemische Analyse durch Spectralbeobachtungen. Annalen der Physik und Chemie. 1861, 189 (7): 337–381. Bibcode:1861AnP...189..337K. doi:10.1002/andp.18611890702.
^ 4.04.1 Weeks, Mary Elvira. The discovery of the elements. XIII. Some spectroscopic discoveries. Journal of Chemical Education. 1932, 9 (8): 1413–1434. Bibcode:1932JChEd...9.1413W. doi:10.1021/ed009p1413.
^ Ritter, Stephen K. C&EN: It's Elemental: The Periodic Table – Cesium. American Chemical Society. 2003 [2010-02-25].
^ Zsigmondy, Richard. Colloids and the Ultra Microscope. Read books. 2007: 69 [2010-09-26]. ISBN 978-1-4067-5938-9.
^ Bunsen, R. Ueber die Darstellung und die Eigenschaften des Rubidiums. Annalen der Chemie und Pharmacie. 1863, 125 (3): 367. doi:10.1002/jlac.18631250314.
^ Lewis, G.M. The natural radioactivity of rubidium. Philosophical Magazine Series 7. 1952, 43 (345): 1070–1074. doi:10.1080/14786441008520248.
^ Campbell, N. R.; Wood, A. The Radioactivity of Rubidium. Proceedings of the Cambridge Philosophical Society. 1908, 14: 15.
^ Butterman, W.C.; Reese, Jr., R.G. Mineral Commodity Profiles Rubidium (PDF). United States Geological Survey. [2010-10-13].
^ Press Release: The 2001 Nobel Prize in Physics. [2010-02-01].
^ Levi, Barbara Goss. Cornell, Ketterle, and Wieman Share Nobel Prize for Bose-Einstein Condensates. Physics Today (Physics Today online year = 2001): 14. Bibcode:2001PhT....54l..14L. doi:10.1063/1.1445529.
^ 13.013.1 Ohly, Julius. Rubidium. Analysis, detection and commercial value of the rare metals. Mining Science Pub. Co. 1910.
^ Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils. Vergleichende Übersicht über die Gruppe der Alkalimetalle. Lehrbuch der Anorganischen Chemie 91–100. Walter de Gruyter. 1985: 953–955. ISBN 3-11-007511-3 (德语).
^ Moore, John W; Stanitski, Conrad L; Jurs, Peter C. Principles of Chemistry: The Molecular Science. 2009: 259. ISBN 978-0-495-39079-4.
^ Smart, Lesley; Moore, Elaine. RbAg4I5. Solid state chemistry: an introduction. CRC Press. 1995: 176–177. ISBN 978-0-7487-4068-0.
^ Bradley, J. N.; Greene, P. D. Relationship of structure and ionic mobility in solid MAg4I5. Trans. Faraday Soc. 1967, 63: 2516. doi:10.1039/TF9676302516.
^ Greenwood, Norman N.; Earnshaw, Alan., Chemistry of the Elements 2nd, Oxford: Butterworth-Heinemann, 1997, ISBN 0080379419
^ 19.019.1 Audi, Georges; Bersillon, O.; Blachot, J.; Wapstra, A.H. The NUBASE Evaluation of Nuclear and Decay Properties. Nuclear Physics A (Atomic Mass Data Center). 2003, 729 (1): 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
^ Strong, W. W. On the Possible Radioactivity of Erbium, Potassium and Rubidium. Physical Review. Series I. 1909, 29 (2): 170–173. Bibcode:1909PhRvI..29..170S. doi:10.1103/PhysRevSeriesI.29.170.
^ Lide, David R; Frederikse, H. P. R. CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data. June 1995: 4–25. ISBN 978-0-8493-0476-7.
^ Universal Nuclide Chart. nucleonica. .
.
^ Planck collaboration; Ade, P. A. R.; Aghanim, N.; Armitage-Caplan, C.; Arnaud, M.; Ashdown, M.; Atrio-Barandela, F.; Aumont, J.; 等. Planck 2013 results. XVI. Cosmological parameters. Submitted to Astronomy & Astrophysics. 2013, 1303: 5076. Bibcode:2014A&A...571A..16P. arXiv:1303.5076. doi:10.1051/0004-6361/201321591.
^ Attendorn, H. -G.; Bowen, Robert. Rubidium-Strontium Dating. Isotopes in the Earth Sciences. Springer. 1988: 162–165. ISBN 978-0-412-53710-3.
^ Walther, John Victor. Rubidium-Strontium Systematics. Essentials of geochemistry. Jones & Bartlett Learning. 1988 2009: 383–385. ISBN 978-0-7637-5922-3. 请检查|date=中的日期值 (帮助)
^ 26.026.126.226.326.4 Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. Mineral Commodity Profile: Rubidium (PDF). United States Geological Survey. 2003 [2010-12-04].
^ Wise, M. A. Trace element chemistry of lithium-rich micas from rare-element granitic pegmatites. Mineralogy and Petrology. 1995, 55 (13): 203–215. Bibcode:1995MinPe..55..203W. doi:10.1007/BF01162588.
^ Norton, J. J. Lithium, cesium, and rubidium—The rare alkali metals. (编) Brobst, D. A., and Pratt, W. P. United States mineral resources. Paper 820. U.S. Geological Survey Professional. 1973: 365–378 [2010-09-26].
^ Bolter, E; Turekian, K; Schutz, D. The distribution of rubidium, cesium and barium in the oceans. Geochimica et Cosmochimica Acta. 1964, 28 (9): 1459. Bibcode:1964GeCoA..28.1459B. doi:10.1016/0016-7037(64)90161-9.
^ McSween, Harry Y; Jr,; Huss, Gary R. Cosmochemistry. 2010: 224. ISBN 978-0-521-87862-3.
^ Teertstra, David K.; Cerny, Petr; Hawthorne, Frank C.; Pier, Julie; Wang, Lu-Min; Ewing, Rodney C. Rubicline, a new feldspar from San Piero in Campo, Elba, Italy. American Mineralogist. 1998, 83 (11–12 Part 1): 1335–1339.
^ bulletin 585. United States. Bureau of Mines. 1995.
^ Cesium and Rubidium Hit Market. Chemical & Engineering News. 1959, 37 (22): 50. doi:10.1021/cen-v037n022.p050.
^ Koch, E.-C. Special Materials in Pyrotechnics, Part II: Application of Caesium and Rubidium Compounds in Pyrotechnics. Journal Pyrotechnics. 2002, 15: 9–24 [2014-12-17]. (原始内容存档于2011-07-13).
^ Boikess, Robert S; Edelson, Edward. Chemical principles. 1981: 193. ISBN 978-0-06-040808-4.
^ Eric Cornell; 等. Bose-Einstein condensation (all 20 articles). Journal of Research of the National Institute of Standards and Technology 101. 1996: 419–618. doi:10.6028/jres.101.045. (原始内容存档于2011-10-14). 引文格式1维护:显式使用等标签 (link)
^ Martin, J L; McKenzie, C R; Thomas, N R; Sharpe, J C; Warrington, D M; Manson, P J; Sandle, W J; Wilson, A C. Output coupling of a Bose-Einstein condensate formed in a TOP trap. Journal of Physics B: Atomic, Molecular and Optical Physics. 1999, 32 (12): 3065. Bibcode:1999JPhB...32.3065M. arXiv:cond-mat/9904007. doi:10.1088/0953-4075/32/12/322.
^ Gentile, T. R.; Chen, W. C.; Jones, G. L.; Babcock, E.; Walker, T. G. Polarized 3He spin filters for slow neutron physics (PDF). Journal of Research of the National Institute of Standards and Technology: 299–304. (原始内容 (PDF)存档于2011年10月18日).
^ Neutron spin filters based on polarized helium-3. NIST Center for Neutron Research 2002 Annual Report. [2008-01-11].
^ Eidson, John C. GPS. Measurement, control, and communication using IEEE 1588. 2006-04-11: 32. ISBN 978-1-84628-250-8.
^ King, Tim; Newson, Dave. Rubidium and crystal oscillators. Data network engineering. 1999-07-31: 300. ISBN 978-0-7923-8594-3.
^ Marton, L. Rubidium Vapor Cell. Advances in electronics and electron physics. 1977-01-01. ISBN 978-0-12-014644-4.
^ Mittal. Introduction To Nuclear And Particle Physics. 2009: 274. ISBN 978-81-203-3610-0.
^ 44.044.1 Li, Zhimin; Wakai, Ronald T.; Walker, Thad G. Parametric modulation of an atomic magnetometer. Applied Physics Letters. 2006, 89 (13): 134105. Bibcode:2006ApPhL..89m4105L. doi:10.1063/1.2357553.
^ Jadvar, H.; Anthony Parker, J. Rubidium-82. Clinical PET and PET/CT. 2005: 59. ISBN 978-1-85233-838-1.
^ Yen, CK; Yano, Y; Budinger, TF; Friedland, RP; Derenzo, SE; Huesman, RH; O'Brien, HA. Brain tumor evaluation using Rb-82 and positron emission tomography. Journal of Nuclear Medicine. 1982, 23 (6): 532–7. PMID 6281406.
^ 47.047.1 Paschalis, C; Jenner, F A; Lee, C R. Effects of rubidium chloride on the course of manic-depressive illness. J R Soc Med. 1978, 71 (9): 343–352. PMC 1436619. PMID 349155.
^ Malekahmadi, P; Williams, John A. Rubidium in psychiatry: Research implications. Pharmacology Biochemistry and Behavior. 1984, 21: 49. doi:10.1016/0091-3057(84)90162-X.
^ Canavese, Caterina; Decostanzi, Ester; Branciforte, Lino; Caropreso, Antonio; Nonnato, Antonello; Sabbioni, Enrico. Depression in dialysis patients: Rubidium supplementation before other drugs and encouragement?. Kidney International. 2001, 60 (3): 1201–1201. doi:10.1046/j.1523-1755.2001.0600031201.x.
^ Lake, James A. Textbook of Integrative Mental Health Care. New York: Thieme Medical Publishers. 2006: 164–165. ISBN 1-58890-299-4.
^ Torta, R; Ala, G; Borio, R; Cicolin, A; Costamagna, S; Fiori, L; Ravizza, L. Rubidium chloride in the treatment of major depression. Minerva psichiatrica. 1993, 34 (2): 101–10. PMID 8412574.
^ Martel, Bernard; Cassidy, Keith. Rubidium. Chemical risk analysis: a practical handbook. 2004-07-01: 215. ISBN 978-1-903996-65-2.
^ Relman, AS. The Physiological Behavior of Rubidium and Cesium in Relation to That of Potassium. The Yale journal of biology and medicine. 1956, 29 (3): 248–62. PMC 2603856. PMID 13409924.
^ Fieve, Ronald R.; Meltzer, Herbert L.; Taylor, Reginald M. Rubidium chloride ingestion by volunteer subjects: Initial experience. Psychopharmacologia. 1971, 20 (4): 307–14. PMID 5561654. doi:10.1007/BF00403562.
^ Meltzer, HL. A pharmacokinetic analysis of long-term administration of rubidium chloride. Journal of clinical pharmacology. 1991, 31 (2): 179–84. PMID 2010564. doi:10.1002/j.1552-4604.1991.tb03704.x. (原始内容存档于2012-07-09).
^ Follis, Richard H., Jr. Histological Effects in rats resulting from adding Rubidium or Cesium to a diet deficient in potassium. AJP – Legacy. 1943, 138 (2): 246. (原始内容存档于2012-07-11).
延伸閱讀
- Meites, Louis (1963). Handbook of Analytical Chemistry (New York: McGraw-Hill Book Company, 1963)
Steck, Daniel A. Rubidium-87 D Line Data (PDF). Los Alamos National Laboratory (technical report LA-UR-03-8638). [2014-12-17]. (原始内容 (PDF)存档于2013-11-02).
外部連結
Rubidium at The Periodic Table of Videos(諾丁漢大學)
| ||||||||||||||
元素周期表 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| | IA 1 | IIA 2 | IIIB 3 | IVB 4 | VB 5 | VIB 6 | VIIB 7 | VIIIB 8 | VIIIB 9 | VIIIB 10 | IB 11 | IIB 12 | IIIA 13 | IVA 14 | VA 15 | VIA 16 | VIIA 17 | VIIIA 18 | ||||||||||||||||||
1 | H | | He | |||||||||||||||||||||||||||||||||
2 | Li | Be | | B | C | N | O | F | Ne | |||||||||||||||||||||||||||
3 | Na | Mg | | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||
4 | K | Ca | | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||
5 | Rb | Sr | | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||
6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||
7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||
| ||||||||||||||||||||||||||||||||||||
| |||||||
|

Comments
Post a Comment