氦
body.skin-minerva .mw-parser-output table.infobox caption{text-align:center}
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外觀 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
无色气体,高压电场下发橙红色光  氦的光谱线 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 氦(helium)·He·2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 稀有气体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
族·週期·區 | 18 ·1·s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 4.002602(2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | 1s2 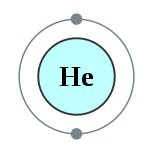 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 發現 | 皮埃尔·让森, 约瑟夫·诺曼·洛克耶(1868年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分離 | 威廉·拉姆齐,皮·特奥多尔·克利夫,尼尔斯·朗勒特(1895年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 气态 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (0 °C, 101.325 kPa) 0.1786 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
熔點時液體密度 | 0.145 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
沸點時液體密度 | 0.125 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | (at 2.5 MPa) 0.95 K,−272.20 °C,−457.96 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 4.222 K,−268.928 °C,−452.070 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 三相點 | 2.177 K(−271 °C),5.043 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 臨界點 | 5.1953 K,0.22746 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | 0.0138 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | 0.0829 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | 5R/2 = 20.786 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸氣壓((由ITS-90定义))
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | N/A(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:2372.3 kJ·mol−1 第二:5250.5 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | 28 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德華半徑 | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 六方密堆积 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 抗磁性[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 0.1513 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 聲速 | 972 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 7440-59-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:氦的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
氦(希臘語:ἥλιος,转写:Helios,直译:太陽;英语:Helium;舊譯作氜)是一种化学元素,其化学符号是He,原子序数是2,是一种无色的惰性气体,放电时发橙红色的光。在常温下,氦是一种极轻的无色、无臭、无味的单原子气体。氦在空氣中含量較少,但在宇宙中是豐度第二高的元素,佔全宇宙物質質量的24%。
目录
1 发现
2 名称由来
3 分布
4 性質
5 制备
6 同位素
7 用途
8 其他
8.1 對聲音的影響
8.2 過度使用所產生的問題
9 參見
10 参考文献
发现
首个证明氦存在的证据是太阳色球的发射光谱中的一条亮黄色谱线。1868年8月18日,法国天文学家皮埃尔·让森在印度的貢土爾观测日全食时,发现了这条波长为587.49 nm的谱线。[2][3]起初人们推测这条谱线来自钠。同年10月20日,英国天文学家约瑟夫·诺曼·洛克耶在太阳光谱中发现了一条黄线。由于这条谱线的波长和夫朗和斐譜線中钠产生的D1线和D2的波长相似,洛克耶将其命名为D3线。[4]他还提出这条谱线来自太阳上的一种尚未在地球上发现的金屬[來源請求]元素。洛克耶和英国化学家爱德华·弗兰克兰以希腊语中的ἥλιος(helios,意为“太阳”)一词,将这一元素命名为Helium.[5][6][7]

氦的谱线
1882年,意大利物理学家路易吉·帕尔米耶里在分析维苏威火山的岩浆时发现了氦的D3线,这是氦在地球上的首次发现记录。[8]

地层氦的发现者威廉·拉姆齐爵士
1895年3月26日,苏格兰化学家威廉·拉姆齐爵士将钇铀矿(一种瀝青鈾礦,其质量的10%为稀土元素)用酸处理,首次在地球上分离出氦。拉姆齐当时在寻找氩,他用硫酸处理矿物,分离释放出的气体中的氮和氧。在剩下的气体中,他发现了一条和太阳光谱中的D3线吻合的黄色谱线。[4][9][10][11]洛克耶和英国物理学家威廉·克鲁克斯鉴定了这一气体样品,证明了它是氦气,且氦非金屬元素。同一年,两位化学家皮·特奥多尔·克利夫和尼尔斯·朗勒特在瑞典乌普萨拉独立从钇铀矿中分离出氦;他们收集的氦足以测定这一元素的原子量。[3][12][13]在拉姆齐分离氦之前,美国地质化学家威廉·弗朗西斯·希尔布兰德同样注意到一份沥青铀矿样品中的一条不寻常的谱线,并从中分离出氦;但他认为这些谱线来自氮气。他致拉姆齐的贺信是科学史上“发现”和“邻近发现”的一个有趣例子。[14]
1907年,欧内斯特·卢瑟福与托马斯·罗伊兹让α粒子穿透玻璃壁进入真空管,向管中放电后观察管内气体的发射光谱,证明α粒子就是氦核。1908年,荷兰物理学家海克·卡末林·昂内斯将氦冷却至不到1K的低温,从而首次制得液态氦。[15]他还试着将氦固化,但是氦没有固、液、气三相平衡的三相点,因此他的尝试没有成功。1926年,昂内斯的学生威廉·亨德里克·科索姆在低温下向氦加压,制得了1 cm3的固态氦。[16]

處於超流相的液氦,會在杯身內面向上緩慢攀爬,攀越過杯口,然後在杯身外面向下緩慢滑落,集結在一起,形成一滴液氦珠,最後滴落在下面的液氦裏。這樣,液氦會一滴一滴的滴落,直到杯子完全流空為止。
1938年,苏联物理学家彼得·列昂尼多维奇·卡皮察发现氦-4在接近绝对零度时几乎没有粘度,从而发现了今天所说的超流体。[17]这一现象和玻色-爱因斯坦凝聚有关。1972年,美国物理学家道格拉斯·奥谢罗夫、戴维·李、以及罗伯特·科尔曼·理查森发现氦-3也有超流体现象,但所需的温度比氦-4低得多。氦-3的超流体现象被认为和氦-3费米子配对形成玻色子有关,这种配对和超导体中电子形成的库珀对类似。[18]
名称由来
在皮埃尔·让森从太阳光谱中发现氦时,英国人洛克耶(J. N. Lockyer)和弗兰克兰(E. F. Frankland)认为这种物质在地球上还没有发现,因此定名为“氦”(法文为hélium,英文为helium),源自希腊语ήλιος,意为“太阳”。
在中文里,晚清时由传教士创办的益智书会译作“氜”(读作“日”),以表示从太阳光中发现的气态元素。1915年,由中华民国教育部颁布的《无机化学命名草案》则采用发音与英文更为一致的“氦”,并沿用至今。[19]
分布
氦存在于整个宇宙中,按质量计占23%。但在自然界中主要存在于天然气或放射性矿石中。在地球大氣層中,氦的濃度十分低,只有体积比百万分之5.2。在地球上的放射性矿物中所含的氦是α衰变的产物。氦在某些天然气中含有在经济上值得提取的量,最高可以含有7%,在美国的天然气中氦大约有1%。在地表的空气中每立方米含有4.6立方厘米的氦,大约占整个体积的0.0005%,密度只有空气的7.2分之一,是除了氢以外密度最小的气体。
性質
氦气是所有气体中最难液化的,沸點僅為4.22K,這源於氦極低的極性。同時,氦是唯一不能在标准大气压下固化的物质,也沒有三相點。基於類似的原因,氦在水中的溶解度也極小,20°C時每升水中僅能溶解8.61毫升。
液氦在温度降至2.178 K(−271 ℃)时,性质会发生突变,粘度极小,能形成只有几个原子厚度的薄膜,发生无粘度流动,成为一种超流体,稱為氦(II),正常的液氦稱作氦(I)。这种氦(II)的表面张力很小,能沿容器壁向上流动,直到兩邊液面等高。此時的氦热传导性为铜的800倍,成為導熱性能極佳的熱導體。其比热容、压缩性等都是反常的。液氦的另一重要性質是能穿透許多常見材料,如PVC、橡膠與大部分玻璃,所以玻璃杜瓦瓶無法用於液氦的操作[20]。
氦的化学性质非常不活泼,一般状态下不會和其他物质发生反应,但目前已获得在高于113GPa压力下热力学稳定的Na2He,并且可能存在15GPa条件下结构类似的Na2HeO。[21]
制备
- 天然气分离法:工业上,主要以含有氦的天然气为原料,反复进行液化分馏,然后利用活性炭进行吸附提纯,得到纯氦。
合成氨法:在合成氨中,从尾气经分离提纯可得氦。- 空气分馏法:从液态空气中用分馏法从氖氦混合气中提出。
- 铀矿石法:将含氦的铀矿石经过焙烧,分离出气体,再经过化学方法,除去水蒸气、氢气和二氧化碳等杂质提纯出氦。
同位素
現時已知的氦同位素有八種,包括氦3、氦4、氦5、氦6、氦8等,但只有氦3和氦4是穩定的,其餘的均帶有放射性。在自然界中,氦同位素中以氦4佔最多,多是從其他放射性物質的α衰變放出α粒子(氦4原子核)而來。氦3的含量在地球上極少,而在月球上储量巨大,它們均是由超重氫(氚)的β衰變所產生。
用途

充滿氦氣,形似氦化學符號(He)的充氣放电管
由于氦很轻,而且不易燃,因此它可用于填充飞艇、气球、温度计、电子管、潛水服等。也可用于原子反应堆和加速器、激光器、冶炼和焊接时的保护气体,还可用来填充灯泡和霓虹灯管,也用来制造泡沫塑料。
由于氦在血液中的溶解度很低,因此可以加到氧气中防止减压病,作为潜水员的呼吸用气体,或用於治療氣喘和窒息。
液体氦的温度(-268.93 °C)接近绝对零度(-273℃),因此它在超导研究中用作超流体,制造超导材料。液态氦还常用做冷却剂和制冷剂。在医学中,用于氩氦刀以治疗癌症。
它还可以用作人造大气层和镭射媒体的组成部分。
由于化学性质极其稳定,一般不与其它物质发生反应,氦气也用于防腐,毛泽东水晶棺内的气体即为氦气[22]。
其他
對聲音的影響
因為氦氣傳播聲音的速度差不多為空氣的三倍,这会改变人的声带的共振态,于是使得吸入氦氣的人說話的聲音的频率變高。這個有趣的現象使得吸入氦氣的人說話尖聲細氣,就好像舊時代的卡通人物一樣[23],與吸入六氟化硫後聲音變粗正好相反。这种现象经常被错误地解释为音速的提高直接导致声音频率的增加,或者氦气使得声带振动变快。
過度使用所產生的問題
需要注意的是,如果大量吸入氦氣,會造成体内氧气被氦取代,因而发生缺氧(呼吸反射是受体内过量二氧化碳驱动,而对缺氧并不敏感),嚴重的甚至會死亡。2015年1月28日,日本少女偶像團體3B junior的一名成員在參加BS朝日的綜藝節目錄影時,因玩變聲遊戲吸入氦氣後失去意識陷入昏迷,被送醫治療[24][25]。同年4月21日,台灣藝人楊又穎吸入過量氦氣自殺身亡。[26]
另外,如果是由高壓氣瓶中直接吸入氦氣,那麼其高流速就會嚴重地破壞肺部組織。大量而高壓的氦和氧會造成高壓緊張症候群,不過少量的氮就能夠處理這個問題。
參見
- 反氦
- 氦-3
- 氦-4
- 氦-5
参考文献
^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存檔,存档日期2012-01-12., in Handbook of Chemistry and Physics 81st edition, CRC press.
^ Kochhar, R. K. French astronomers in India during the 17th – 19th centuries. Journal of the British Astronomical Association. 1991, 101 (2): 95–100. Bibcode:1991JBAA..101...95K.
^ 3.03.1 Emsley, John. Nature's Building Blocks. Oxford: Oxford University Press. 2001: 175–179. ISBN 0-19-850341-5.
^ 4.04.1 Clifford A. Hampel. The Encyclopedia of the Chemical Elements. New York: Van Nostrand Reinhold. 1968: 256–268. ISBN 0-442-15598-0.
^ Sir Norman Lockyer – discovery of the element that he named helium 页面存档备份,存于互联网档案馆" Balloon Professional Magazine, 7 August 2009.
^ Helium. Oxford English Dictionary. 2008 [2008-07-20].
^ Thomson, William. Inaugural Address of Sir William Thompson. Nature. Aug 3, 1871, 4 (92): 261–278 [268]. Bibcode:1871Natur...4..261.. doi:10.1038/004261a0.Frankland and Lockyer find the yellow prominences to give a very decided bright line not far from D, but hitherto not identified with any terrestrial flame. It seems to indicate a new substance, which they propose to call Helium
^ Stewart, Alfred Walter. Recent Advances in Physical and Inorganic Chemistry. BiblioBazaar, LLC. 2008: 201. ISBN 0-554-80513-8.
^ Ramsay, William. On a Gas Showing the Spectrum of Helium, the Reputed Cause of D3 , One of the Lines in the Coronal Spectrum. Preliminary Note. Proceedings of the Royal Society of London. 1895, 58 (347–352): 65–67. doi:10.1098/rspl.1895.0006.
^ Ramsay, William. Helium, a Gaseous Constituent of Certain Minerals. Part I. Proceedings of the Royal Society of London. 1895, 58 (347–352): 80–89. doi:10.1098/rspl.1895.0010.
^ Ramsay, William. Helium, a Gaseous Constituent of Certain Minerals. Part II--. Proceedings of the Royal Society of London. 1895, 59 (1): 325–330. doi:10.1098/rspl.1895.0097.
^ (德文) Langlet, N. A. Das Atomgewicht des Heliums. Zeitschrift für anorganische Chemie. 1895, 10 (1): 289–292. doi:10.1002/zaac.18950100130 (德语).
^ Weaver, E.R. Bibliography of Helium Literature. Industrial & Engineering Chemistry. 1919.
^ Munday, Pat. John A. Garraty and Mark C. Carnes, 编. Biographical entry for W.F. Hillebrand(1853–1925), geochemist and U.S. Bureau of Standards administrator in American National Biography 10–11. Oxford University Press. 1999: 808–9; 227–8.
^ van Delft, Dirk. Little cup of Helium, big Science (PDF). Physics Today. 2008: 36–42 [2008-07-20]. (原始内容 (PDF)存档于2008年6月25日).
^ Coldest Cold. Time Inc. 1929-06-10 [2008-07-27].
^ Kapitza, P. Viscosity of Liquid Helium below the λ-Point. Nature. 1938, 141 (3558): 74. Bibcode:1938Natur.141...74K. doi:10.1038/141074a0.
^ Osheroff, D. D.; Richardson, R. C.; Lee, D. M. Evidence for a New Phase of Solid He3. Phys. Rev. Lett. 1972, 28 (14): 885–888. Bibcode:1972PhRvL..28..885O. doi:10.1103/PhysRevLett.28.885.
^ 余恒. 被遗忘的元素用字. 中国科技术语. 2013, 15 (6): 53–55 [2014-03-20].
^ 高等教育出版社《無機化學》(第四版)北京師範大學無機化學教研室等編
^ Dong, Xiao; Oganov, Artem R.; Goncharov, Alexander F.; Stavrou, Elissaios; Lobanov, Sergey; Saleh, Gabriele; Qian, Guang-Rui; Zhu, Qiang; Gatti, Carlo. A stable compound of helium and sodium at high pressure. Nature Chemistry. 2017-02-06, 9 (5): nchem.2716. doi:10.1038/nchem.2716 (英语).
^ 毛泽东水晶棺造价不菲用35吨天然水晶制成. 新闻午报. 东方网. 2005-09-21 [2011-07-02].
^ 喝「笑氣調酒」變唐老鴨聲
^ 日綜玩出禍 12歲女星吸氦氣昏迷不醒. 中時電子報. 2015-02-05. (原始内容存档于2015-02-08).
^ [1]
^ 楊又穎輕生!吸氦氣腦部傷救不回 後遺症更甚於笑氣
元素周期表(稀有气体) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| | IA 1 | IIA 2 | IIIB 3 | IVB 4 | VB 5 | VIB 6 | VIIB 7 | VIIIB 8 | VIIIB 9 | VIIIB 10 | IB 11 | IIB 12 | IIIA 13 | IVA 14 | VA 15 | VIA 16 | VIIA 17 | VIIIA 18 | ||||||||||||||||||
1 | H | | He | |||||||||||||||||||||||||||||||||
2 | Li | Be | | B | C | N | O | F | Ne | |||||||||||||||||||||||||||
3 | Na | Mg | | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||
4 | K | Ca | | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||
5 | Rb | Sr | | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||
6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||
7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||
| ||||||||||||||||||||||||||||||||||||
|

Comments
Post a Comment