铌
body.skin-minerva .mw-parser-output table.infobox caption{text-align:center}
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外觀 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
灰色金屬質,氧化後呈藍色  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 |
鈮(Niobium)·Nb·41 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 過渡金屬 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
族·週期·區 |
5 ·5·d |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 92.90637(2) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | [氪] 4d4 5s1  |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 發現 | 查理斯·哈契特(1801年) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分離 | 克利斯蒂安·威廉·布隆斯特蘭(1864年) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 證明為化學元素 |
海因里希·羅澤(1844年) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 固體 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 8.57 g·cm−3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | 2750 K,2477 °C,4491 °F |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 5017 K,4744 °C,8571 °F |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | 30 kJ·mol−1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | 689.9 kJ·mol−1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | 24.60 J·mol−1·K−1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸氣壓
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | 5, 4, 3, 2, -1 (弱酸性氧化物) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | 1.6(鲍林标度) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:652.1 kJ·mol−1 第三:2416 kJ·mol−1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半徑 | 146 pm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | 164±6 pm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 體心立方 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 順磁性 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電阻率 | (0 °C)152 n Ω·m |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 53.7 W·m−1·K−1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨脹係數 | 7.3 µm/(m·K) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
聲速(細棒) |
(20 °C)3480 m·s−1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 楊氏模量 | 105 GPa |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 38 GPa |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 體積模量 | 170 GPa |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.40 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 6.0 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 維氏硬度 | 1320 MPa |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 736 MPa |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 7440-03-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:鈮的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
鈮(IUPAC名:niobium,化學符号:Nb)[1]是原子序為41的化學元素,曾有舊稱鈳(Columbium,化學符号:Cb)原在美洲使用,1949年IUPAC決定採歐洲使用的名稱[2]。鈮是一種質軟的灰色可延展過渡金屬,一般出現在燒綠石和鈮鐵礦中。其命名來自希臘神話中的尼俄伯,即坦塔洛斯之女。
鈮的化學和物理性質與鉭元素相近,因此兩者很難區分開來。英國化學家查理斯·哈契特在1801年宣佈發現一種近似於鉭的新元素,並將它命名為「Columbium」(鈳)。1809年,英國化學家威廉·海德·沃拉斯頓錯誤地把鉭和鈳判定為同一個元素。德國化學家海因里希·羅澤在1846年得出結論,指鉭礦物中確實存在另一種元素,他將其命名為「Niobium」(鈮)。在1864至1865年進行的一系列研究最终确认,鈮和鈳實為同一元素,與鉭則是不同的元素。接下來的一個世紀內,兩種稱呼都被廣泛通用。1949年,鈮成為了這一元素的正式命名,但美國至今仍在冶金學文獻中使用舊名「鈳」。
鈮直到20世紀初才開始有商業應用。巴西是目前鈮和鐵鈮合金的最大產國。鈮一般被用於製作合金,最重要的應用在特殊鋼材,例如天然氣運輸管道材料。雖然這些合金的含鈮量不會超過0.1%,但加入少量的鈮即可達到強化鋼材的作用。含鈮的高溫合金具有高溫穩定性,對製造噴射引擎和火箭引擎非常有用。鈮是第II類超導體的合金成份。這些超導體也含有鈦和錫,被廣泛應用在核磁共振成像掃描儀作超導磁鐵。 鈮的毒性低,亦很容易用陽極氧化處理進行上色,所以被用於錢幣和首飾。鈮的其他應用範疇還包括焊接、核工業、電子和光學等。
目录
1 歷史
1.1 命名
2 性質
2.1 物理性質
2.2 化學性質
2.3 同位素
2.4 存量
3 生產
4 化合物
4.1 氧化物及硫化物
4.2 鹵化物
4.3 氮化物及碳化物
5 應用
5.1 鋼鐵生產
5.2 高溫合金
5.3 鈮基合金
5.4 超導磁鐵
5.4.1 其他超導應用
5.5 其他用途
5.5.1 電瓷
5.5.2 醫用和首飾
5.5.3 錢幣
5.5.4 其他
6 安全
7 參考資料
8 外部連結
歷史

「鈳」的發現者,查理斯·哈契特

尼俄伯,希臘式雕塑
1801年,英國化學家查理斯·哈契特發現了鈮元素。[3]他在1734年從美國馬薩諸賽州寄來的一份礦物樣本中,辨認出了一種新的元素。他根據美國一個帶有詩意的別名哥倫比亞(Columbia)將這種礦物命名為「Columbite」(鈳鐵礦)。[4][5][6]哈契特所發現的「鈳」很可能是新元素與鉭的混合物。[4]
當時,科學家未能有效地把鈳(鈮)和性質極為相似的鉭區分開來。[7]1809年,英國化學家威廉·海德·沃拉斯頓(William Hyde Wollaston)對鈳和鉭的氧化物進行比較,得出兩者的密度分別為5.918 g/cm3及超過8 g/cm3。雖然密度值相差巨大,但他仍認為兩者是完全相同的物質。[7]另一德國化學家海因里希·羅澤(Heinrich Rose)在1846年駁斥這一結論,並稱原先的鉭鐵礦樣本中還存在着另外兩種元素。他以希臘神話中坦塔洛斯的女兒尼俄伯(Niobe,淚水女神)和兒子珀羅普斯(Pelops)把這兩種元素分別命名為「Niobium」(鈮)和「Pelopium」。[8][9]鉭和鈮的差別細微,而因此得出的新「元素」Pelopium、Ilmenium和Dianium[10]實際上都只是鈮或者鈮鉭混合物。[11]
1864年,克利斯蒂安·威廉·布隆斯特蘭(Christian Wilhelm Blomstrand)、[11]亨利·愛丁·聖克萊爾·德維爾和路易·約瑟夫·特羅斯特(Louis Joseph Troost)明確證明了鉭和鈮是兩種不同的化學元素,並確定了一些相關化合物的化學公式。[11][12]瑞士化學家讓-夏爾·加利薩·德馬里尼亞(Jean Charles Galissard de Marignac)[13]在1866年進一步證實除鉭和鈮以外別無其他元素。然而直到1871年還有科學家發表有關Ilmenium的文章。[14]
1864年,德馬里尼亞在氫氣中對氯化鈮進行還原反應,首次製成鈮金屬。[15]雖然他在1866年已能夠製備不含鉭的鈮金屬,但要直到20世紀初,鈮才開始有商業上的應用:電燈泡燈絲。[12]鈮很快就被鎢淘汰了,因為鎢的熔點比鈮更高,更適合作燈絲材料。1920年代,人們發現鈮可以加強鋼材,這成為鈮一直以來的主要用途。[12]貝爾實驗室的尤金·昆茲勒(Eugene Kunzler)等人發現,鈮錫在強電場、磁場環境下仍能保持超導性,[16]這使鈮錫成為第一種能承受高電流和磁場的物質,可用於大功率磁鐵和電動機械。這一發現促使了20年後多股長電纜的生產。這種電纜在繞成線圈後可形成大型強電磁鐵,用在旋轉機械、粒子加速器和粒子探測器當中。[17][18]
命名
「Columbium」(鈳,符號Cb[19])是哈契特對新元素所給的最早命名。這一名稱在美國一直有廣泛的使用,美國化學學會在1953年出版了最後一篇標題含有「鈳」的論文;[20]「鈮」則在歐洲通用。1949年在阿姆斯特丹舉辦的化學聯合會第15屆會議最終決定以「鈮」作為第41號元素的正式命名。[21]翌年,國際純粹與應用化學聯合會(IUPAC)也採納了這一命名,結束了一個世紀來的命名分歧,儘管「鈳」的使用時間更早。[21]這可算是一種妥協:[21]IUPAC依北美的用法選擇「Tungsten」而非歐洲所用的「Wolfram」作為鎢的命名,並在鈮的命名上以歐洲的用法為先。具權威性的化學學會和政府機構都一般以IUPAC正式命名稱之,但美國地質調查局以及冶金業、金屬學會等組織至今仍使用舊名「鈳」。[22][23]
性質
物理性質
鈮是一種帶光澤的灰色金屬,具有順磁性,屬於元素週期表上的5族。高純度鈮金屬的延展性較高,但會隨雜質含量的增加而變硬。[24]它的最外電子層排布和其他的5族元素非常不同。同樣的現象也出現在前後的釕(44)、銠(45)和鈀(46)元素上。
| Z | 元素 | 每層電子數 |
|---|---|---|
| 23 | 釩 | 2, 8, 11, 2 |
| 41 | 鈮 | 2, 8, 18, 12, 1 |
| 73 | 鉭 | 2, 8, 18, 32, 11, 2 |
| 105 | 𨧀 | 2, 8, 18, 32, 32, 11, 2(預測) |
鈮在低溫狀態下會呈現超導體性質。在標準大氣壓力下,它的臨界溫度為9.2 K,是所有單質超導體中最高的。[25]其磁穿透深度也是所有元素中最高的。[25]鈮是三種單質第II類超導體之一,其他兩種分別為釩和鍀。鈮金屬的純度會大大影響其超導性質。[26]
鈮對於熱中子的捕獲截面很低,[27]因此在核工業上有相當的用處。[28]
化學性質
鈮金屬在室溫下長時間存留後,會變為藍色。[29]雖然它在單質狀態下的熔點較高(2,468 °C),但其密度卻比其他難熔金屬低。[30]鈮能夠抵禦多種酸和鹼的侵蝕。[24]
鈮的電正性比位於其左邊的鋯元素低。其原子大小和位於其下方的鉭元素原子幾乎相同,這是鑭系收縮效應所造成的。[24]這使得鈮的化學性質與鉭非常相近。[12]雖然它的抗腐蝕性沒有鉭這麼高,但是它價格更低,也更為常見,所以在要求較低的情況下常用以代替鉭,例如作化工廠化學物槽內塗層物料。[24]
同位素
自然產生的鈮由一種穩定同位素組成:93Nb。[31]截至2003年,已合成的放射性同位素共有至少32種,原子量在81和113之間。其中最穩定的是92Nb,半衰期有3470萬年;113Nb是最不穩定的同位素之一,其半衰期估計只有30毫秒。比93Nb更輕的同位素一般進行β+衰變,比它重的則會進行β−衰變。例外包括:81Nb、82Nb和84Nb會進行少量β+緩發質子發射,91Nb會進行電子捕獲和正電子發射,而92Nb會同時進行正電子(β+)和電子(β-)發射。[31]
已知的同核異構體共有25種,質量數介乎84至104。這個質量區間內的同位素中,只有96Nb、101Nb和103Nb不具有同核異構體。最穩定的鈮同核異構體是93mNb,半衰期為16.13年;最不穩定的是84mNb,半衰期為103納秒。除92m1Nb進行少量電子捕獲之外,所有同核異構體的衰變方式都是同核異構體轉換或β衰變。 [31]
存量
根據估算,鈮在地球地殼中的豐度為百萬分之20,在所有元素中排列第33位。[32]部份科學家認為,鈮在整個地球中的含量更高,但因密度高而主要聚集在地核中。[22]鈮在自然界中不以純態出現,而是和其他元素結合形成礦物。[24]這些礦物一般也含有鉭元素,例如鈳鐵礦(即鈮鐵礦,(Fe,Mn)(Nb,Ta)2O6)和鈳鉭鐵礦((Fe,Mn)(Ta,Nb)2O6)。[33]含鈮、鉭的礦物通常是偉晶岩和鹼性侵入岩中的副礦物。其他礦物還有鈣、鈾和釷以及稀土元素的鈮酸鹽,例如燒綠石((Na,Ca)2Nb2O6(OH,F))和黑稀金礦((Y,Ca,Ce,U,Th)(Nb,Ta,Ti)2O6)等。這些大型鈮礦藏出現在碳酸鹽岩(一種碳酸鹽、硅酸鹽火成岩)附近,亦是燒綠石的組成成份。[34]
巴西和加拿大擁有最大的燒綠石礦藏。兩國在1950年代發現這些礦藏,至今仍是鈮精礦的最大產國。[12]世界最大礦藏位於巴西米納斯吉拉斯州阿拉沙的一處碳酸鹽侵入岩地帶,屬於CBMM(巴西礦物冶金公司);另一礦藏位於戈亞斯,屬於英美資源,同樣是碳酸鹽侵入岩。[35]以上兩個礦場的產量佔世界總產量的75%。第三大礦場位於加拿大魁北克省薩格奈附近,產量佔世界7%。[35]
生產
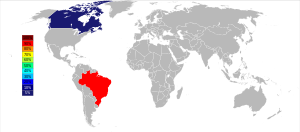
2006年全球鈮生產分佈
開採所得的礦石要經過分離過程,使五氧化二鉭(Ta2O5)和五氧化二铌(Nb2O5)從其他礦物中脫離出來。加工過程的首個步驟是與氫氟酸反應:[33]
- Ta2O5 + 14 HF → 2 H2[TaF7] + 5 H2O
- Nb2O5 + 10 HF → 2 H2[NbOF5] + 3 H2O
讓-夏爾·加利薩·德馬里尼亞發明了產業規模的分離方法,利用了鈮和鉭的氟化物配合物所擁有的水溶性差異。新的方法則使用類似環己酮的有機溶劑把氟化物從水溶液中萃取出來,[33]再用水將鈮和鉭的配合物從有機溶劑中分別提取。加入氟化鉀能使鈮沉澱成氟化鉀配合物,而加入氨則可沉澱出五氧化二鈮:[36]
- H2[NbOF5] + 2 KF → K2[NbOF5]↓ + 2 HF
然後:[37]
- 2 H2[NbOF5] + 10 NH4OH → Nb2O5↓ + 10 NH4F + 7 H2O
從化合物到金屬態的還原方法有幾種。一是對K2[NbOF5]和氯化鈉的熔融混合物進行電解,二是用鈉對氟化鈮進行還原。這種方法所得出的鈮金屬具有較高的純度。在大規模生產中,則一般使用氫或碳對Nb2O5進行還原。[36]另一種方法利用鋁熱反應,其中氧化鐵和氧化鈮與鋁反應:[38]
- 3 Nb2O5 + Fe2O3 + 12 Al → 6 Nb + 2 Fe + 6 Al2O3
少量類似硝酸鈉的氧化添加劑可以加強以上反應。這樣會產生氧化鋁和鈮鐵合金,後者可用於鋼鐵生產。[39][40]鈮鐵一般含有60%至70%的鈮。[35]如不加入氧化鐵,鋁熱反應會產生鈮金屬,不過要經純化過程才可製成具超導性質的高純度鈮合金。世界最大的兩家鈮經銷商所用的方法是真空電子束熔煉。[41][42]
截至2013年,巴西冶金及礦業有限公司(葡萄牙語:Cia. Brasileira de Metalurgia & Mineração)控制了世界85%的鈮生產。[43]美國地質調查局估計,鈮產量從2005年的38,700噸升至2006年的44,500噸。[44][45]全球鈮資源存量估計有440萬噸。[45]在1995至2005年間,產量從17,800噸上升至雙倍以上。[46]2009年至2011年,產量維持在每年63,000噸的穩定狀態。[47]
| 國家 |
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
2009 |
2010 |
2011 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 160 | 230 | 290 | 230 | 200 | 200 | 200 | ? | ? | ? | ? | ? |
|
| 30,000 | 22,000 | 26,000 | 29,000 | 29,900 | 35,000 | 40,000 | 57,300 | 58,000 | 58,000 | 58,000 | 58,000 |
|
| 2,290 | 3,200 | 3,410 | 3,280 | 3,400 | 3,310 | 4,167 | 3,020 | 4,380 | 4,330 | 4,420 | 4,400 |
|
| ? | 50 | 50 | 13 | 52 | 25 | ? | ? | ? | ? | ? | ? |
|
| ? | ? | 5 | 34 | 130 | 34 | 29 | ? | ? | ? | ? | ? |
|
| 35 | 30 | 30 | 190 | 170 | 40 | 35 | ? | ? | ? | ? | ? |
|
| 28 | 120 | 76 | 22 | 63 | 63 | 80 | ? | ? | ? | ? | ? |
|
| 全球 | 32,600 | 25,600 | 29,900 | 32,800 | 34,000 | 38,700 | 44,500 | 60,400 | 62,900 | 62,900 | 62,900 | 63,000 |
化合物
鈮在很多方面都與鉭及鋯十分相似。它會在室溫下與氟反應,在200 °C下與氯和氫反應,以及在400 °C下與氮反應,產物一般都是間隙非整比化合物。[24]鈮金屬在200 °C下會在空氣中氧化,[36]且能抵禦熔融鹼和各種酸的侵蝕,包括王水、氫氯酸、硫酸、硝酸和磷酸等。[24]不過它會受水溶氫氟酸和無水氫氟酸的侵蝕。[49]
雖然鈮可以形成氧化態為+5至−1的各種化合物,但它最常見的還是處於+5氧化態。[24]
氧化物及硫化物
鈮的氧化物可以有以下的氧化態:+5(Nb2O5)、+4(NbO2)和+3(Nb2O3),[36]另外較罕見的有+2態(NbO)。[50]五氧化二鈮是最常見的鈮氧化物,鈮金屬及所有鈮化合物的製備都需從其開始。[36][51]要製成鈮酸鹽,可將五氧化二鈮溶於鹼性氫氧化物溶液中,或熔化於鹼金屬氧化物中。鈮酸鋰(LiNbO3)具有鈣鈦礦型偏三方晶系結構,而鈮酸鑭則含孤立的NbO3−
4離子。[36]其他已知化合物還包括硫化鈮(NbS2),它會形成層狀結構。[24]
利用化學氣相沉積法或原子層沉積法可以在物料表面加上五氧化二鈮薄層,兩種方法均用到乙醇鈮(V)在350 °C以上會熱分解的原理。[52][53]
鹵化物

經部份水解(白色部份)的五氯化鈮(黃色部份)

五氯化鈮的球棒模型。五氯化鈮會形成二聚體
鈮可以形成擁有+5和+4氧化態的鹵化物,以及各種亞化學計量化合物。[36][41]五鹵化鈮(NbX5)含有八面體型鈮中心原子。五氟化鈮(NbF5)是一種白色固體,熔點為79.0 °C,而五氯化鈮(NbCl5則呈黃色(見左圖),熔點為203.4 °C。兩者均可經水解形成氧化物和鹵氧化物,例如NbOCl3。五氯化鈮也是一種具揮發性的試劑,可用於合成包括二氯二茂鈮((C5H5)2NbCl2)在內的各種有機金屬化合物。[54]鈮的四鹵化物(NbX4)都是深色的聚合物,內含鈮﹣鈮鍵,如呈黑色、具吸濕性的四氟化鈮(NbF4)和紫黑色的四氯化鈮(NbCl4)。[55]
鈮的鹵化物負離子也存在,這是因為鈮的五鹵化物都是路易斯酸。最重要的一種為[NbF7]2-,它是鈮和鉭的礦物分離過程中的一個中間化合物。[33]它比對應的鉭化合物更易轉換為氧五氟化物。其他鹵化配合物還包括[NbCl6]−:[56]
- Nb2Cl10 + 2 Cl− → 2 [NbCl6]−
鈮還會形成多種還原鹵化物原子簇,如[Nb6Cl18]4−。[57]
氮化物及碳化物
氮化鈮(NbN)在低溫下會變成超導體,被用在紅外線探測器中。[58]碳化鈮(NbC、Nb2C)是一種硬度極高的耐火材料,可用於製造切割工具刀頭。[59]
應用

鈮金屬薄片
經估計,在2006年開採出的44,500噸鈮當中,90%用於製造優質鋼材,其次為高溫合金。[60]用於超導體合金以及電子元件的鈮只佔產量的小部份。[60]
鋼鐵生產
鈮是微合金鋼生產過程中一種優秀的添加元素。在鋼中加入鈮,會使鋼結構中形成碳化鈮和氮化鈮。[22]這些物質可使鋼晶粒更為細緻,減緩再結晶過程,以及增強鋼的淀積硬化。如此形成的鋼材具有較高的硬度、強度、可模鍛性和可焊性。[22]微合金不鏽鋼的鈮含量在0.1%以下。[61]高強度低合金鋼的生產中需加入鈮,這類鋼材被用於汽車的結構零件中。[22]含鈮合金還被用在運輸管道上。[62][63]
高溫合金

在繞月軌道上的阿波羅15號指令服務艙(CSM),其深色火箭噴管以鈮鈦合金作為材料
世界上很大一部份鈮以純金屬態或以高純度鈮鐵和鈮鎳合金的形態,用於生產鎳、鉻和鐵基高溫合金。這些合金可用於噴射引擎、燃氣渦輪發動機、火箭組件、渦輪增壓器和耐熱燃燒器材。鈮在高溫合金的晶粒結構中會形成γ''相態。[64]這類合金一般含有最高6.5%的鈮。[61]Inconel 718合金是其中一種含鈮鎳基合金,各元素含量分別為:鎳50%、鉻18.6%、鐵18.5%、鈮5%、鉬3.1%、鈦0.9%以及鋁0.4%。[65][66]應用包括作為高端機體材料,如曾用於雙子座計劃。[67]
C-103是一種鈮合金,它含有89%的鈮、10%的鉿和1%的鈦,可用於液態火箭推進器噴管,例如阿波羅登月艙的主引擎。阿波羅服務艙則使用另一種鈮合金。由於鈮在400 °C以上會開始氧化,所以為了防止它變得易碎,須在其表面塗上保護塗層。[68]
鈮基合金
C-103合金是1960年代初由華昌公司和波音公司共同研發的鈮合金。由於冷戰和太空競賽的緣故,杜邦、美國聯合碳化物、通用電氣等多個美國公司都在同時研發鈮基合金。鈮和氧容易反應,所以生產過程需在真空或惰性氣體環境下進行,這大大增加了成本和難度。真空電弧重熔(VAR)和電子束熔煉(EBM)是當時最先進的生產過程,促使了各種鈮合金的發展。1959年起,研究項目在測試了「C系」(可能取了舊名鈳「Columbium」的首字母)中共256種鈮合金後,終於製得了C-103。這些合金都可熔化成顆粒狀或片狀。華昌當時擁有從核級鋯合金提煉而成的鉿元素,並希望發展它的商業應用。C系中擁有所謂103rd成份比例的Nb-10Hf-1Ti合金在可模鍛性和高溫屬性之間有著最佳的平衡,因此華昌於1961年利用VAR和EBM方法生產了首批500磅C-103合金,應用於渦輪引擎部件和液態金屬換熱器。同期的其他鈮合金還有:芬斯蒂爾冶金公司的FS85(Nb-10W-28Ta-1Zr)、華昌和波音的Cb129Y(Nb-10W-10Hf-0.2Y)、聯合碳化物的Cb752(Nb-10W-2.5Zr)及蘇必利爾管道公司的Nb1Zr。[68]
超導磁鐵

內含鈮超導合金的3特斯拉臨床核磁共振成像掃描儀
鈮鍺(Nb3Ge)、鈮錫(Nb3Sn)和鈮鈦合金都可以作超導磁鐵中的第II類超導體電線。[69][70]這些超導磁鐵被用於核磁共振成像和各種核磁共振儀器,以及粒子加速器當中。[71]例如,大型強子對撞機安裝了600噸重的超導股線,國際熱核聚變實驗反應堆估計用到了600噸Nb3Sn股線和250噸NbTi股線。[72]單在1992年,就有共值10億美元的鈮鈦電線被用於臨床核磁共振成像儀器上。[17]
其他超導應用
漢堡自由電子激光器(FLASH)和歐洲X射線自由電子激光器(XFEL)所用的超導射頻加速腔都是由純鈮製成的。[73]
用氮化鈮製造的微輻射熱測量計非常靈敏,因此特別適合用來探測處於THz頻帶的電磁輻射。這種測量計曾被用在海因里希·赫茲亞毫米望遠鏡、南極望遠鏡、接收器實驗室望遠鏡和阿塔卡馬開創實驗上,並在目前用於赫歇爾太空望遠鏡上的HIFI儀器中。[74]
其他用途
電瓷
鈮酸鋰是一種鐵電性物質,在手提電話和光調變器中以及表面聲波設備的製造上有廣泛的應用。它的晶體結構屬於ABO3型,與鉭酸鋰和鈦酸鋇相同。[75]鈮可以代替鉭電容器中的鉭,降低成本。[76]
醫用和首飾
鈮和某些鈮合金對生物體呈惰性,不易致敏。因此鈮被用在各種醫學設備中,例如心律調節器。[77]經氫氧化鈉處理過的鈮會形成多孔表層,這有助於骨整合。[78]
與鈦、鉭和鋁一樣,鈮也可以經陽極氧化上色處理,所以可用作首飾。[79][80]鈮的過敏性低,適合當做首飾。[81]
錢幣
在錢幣上,鈮有時會與金和銀一起用在紀念幣上作貴重金屬。例如,奧地利自2003年起,生產了一系列銀鈮歐羅幣,其顏色是陽極化過程形成的氧化物表層衍射所產生的。[82]2012年,共有十種中心顏色不同的錢幣,共包括藍、綠、棕、紫和黃。另外含有鈮的錢幣還有2004年的奧地利賽梅林鐵路150週年紀念幣,[83]以及2006年歐洲衛星導航紀念幣。[84]2011年,加拿大皇家造幣廠開始鑄造稱為「狩獵月」(Hunter's Moon)的5加元純銀和鈮幣。[85]
其他
鈮(或摻有1%鋯)是高壓鈉燈電弧管的密封材料,因為鈮的熱膨脹係數與經燒結的礬土弧光燈陶瓷材料非常相近。這種用於鈉燈的陶瓷可以抵禦化學侵蝕,也不會與燈內的高溫鈉液體和氣體產生還原反應。[86][87][88]鈮也被用在電弧焊條上,用來焊接某些穩定化不鏽鋼。[89]一些大型水箱的陰極保護系統中以鈮作為陽極的材料,陽極一般再鍍上一層鉑。[90][91]
安全
鈮元素沒有已知的生物用途。鈮粉末會刺激眼部和皮膚,並有可能引發火災;但成塊鈮金屬則完全不影響生物體(低過敏性),因此是無害物質。鈮常見於首飾中,而一些醫學植入物也含有鈮。[92][93]
某一些鈮化合物具有毒性,但一般人很難接觸到這些物質。鈮酸鹽和氯化鈮都可溶於水,科學家已在老鼠身上進行了實驗,觀察短期和長期接觸這些化合物所帶來的效果。對於老鼠,單次注入五氯化鈮或鈮酸鹽的半數致死量(LD50)為10至100 mg/kg之間。[94][95][96]經口服的毒性較低,對於老鼠的LD50值在七天後為940 mg/kg。[94]
參考資料
.mw-parser-output .refbegin{font-size:90%;margin-bottom:0.5em}.mw-parser-output .refbegin-hanging-indents>ul{list-style-type:none;margin-left:0}.mw-parser-output .refbegin-hanging-indents>ul>li,.mw-parser-output .refbegin-hanging-indents>dl>dd{margin-left:0;padding-left:3.2em;text-indent:-3.2em;list-style:none}.mw-parser-output .refbegin-100{font-size:100%}
^
PubChem Open Chemistry Database, Niobium, 美国国家生物技术信息中心, 1995 [May 15, 2015], (原始内容存档于五月 17, 2015) 请检查|archive-date=中的日期值 (帮助)
^ By Christopher Brooks, The periodic table: how elements get their names, 14 November 2013
^ 參見:
- Charles Hatchett (1802) "An analysis of a mineral substance from North America, containing a metal hitherto unknown", Philosophical Transactions of the Royal Society of London, 92 : 49–66.
Hatchett, Charles. Eigenschaften und chemisches Verhalten des von Charles Hatchett entdeckten neuen Metalls, Columbium [Properties and chemical behavior of the new metal, columbium, (that was) discovered by Charles Hatchett]. Annalen der Physik. 1802, 11 (5): 120–122. Bibcode:1802AnP....11..120H. doi:10.1002/andp.18020110507 (德语).
^ 4.04.1 Noyes, William Albert. A Textbook of Chemistry. H. Holt & Co. 1918: 523 [2014-03-12].
^ Percival, James. Middletown Silver and Lead Mines. Journal of Silver and Lead Mining Operations. July–December 1853, 1: 186 [2013-04-24].
^ Griffith, William P.; Morris, Peter J. T. Charles Hatchett FRS (1765–1847), Chemist and Discoverer of Niobium. Notes and Records of the Royal Society of London. 2003, 57 (3): 299. JSTOR 3557720. doi:10.1098/rsnr.2003.0216. 引文使用过时参数coauthors (帮助)
^ 7.07.1 Wollaston, William Hyde. On the Identity of Columbium and Tantalum. Philosophical Transactions of the Royal Society. 1809, 99: 246–252. JSTOR 107264. doi:10.1098/rstl.1809.0017.
^ Rose, Heinrich. Ueber die Zusammensetzung der Tantalite und ein im Tantalite von Baiern enthaltenes neues Metall. Annalen der Physik. 1844, 139 (10): 317–341. Bibcode:1844AnP...139..317R. doi:10.1002/andp.18441391006 (德语).
^ Rose, Heinrich. Ueber die Säure im Columbit von Nordamérika. Annalen der Physik. 1847, 146 (4): 572–577. Bibcode:1847AnP...146..572R. doi:10.1002/andp.18471460410 (德语).
^ Kobell, V. Ueber eine eigenthümliche Säure, Diansäure, in der Gruppe der Tantal- und Niob- verbindungen. Journal für Praktische Chemie. 1860, 79 (1): 291–303. doi:10.1002/prac.18600790145.
^ 11.011.111.2 Marignac, Blomstrand, H. Deville, L. Troost und R. Hermann. Tantalsäure, Niobsäure, (Ilmensäure) und Titansäure. Fresenius' Journal of Analytical Chemistry. 1866, 5 (1): 384–389. doi:10.1007/BF01302537.
^ 12.012.112.212.312.4 Gupta, C. K.; Suri, A. K. Extractive Metallurgy of Niobium. CRC Press. 1994: 1–16. ISBN 0-8493-6071-4. 引文使用过时参数coauthors (帮助)
^ Marignac, M. C. Recherches sur les combinaisons du niobium. Annales de chimie et de physique. 1866, 4 (8): 7–75 (法语).
^ Hermann, R. Fortgesetzte Untersuchungen über die Verbindungen von Ilmenium und Niobium, sowie über die Zusammensetzung der Niobmineralien(有關Ilmenium和鈮化合物以及鈮礦物成份的進一步研究). Journal für Praktische Chemie. 1871, 3 (1): 373–427. doi:10.1002/prac.18710030137 (德语).
^ Niobium. Universidade de Coimbra. [2008-09-05].
^ Geballe et al. (1993)中所述的臨界點為150千安培電流及8.8特斯拉磁場。
^ 17.017.1 Geballe, Theodore H. Superconductivity: From Physics to Technology. Physics Today. October 1993, 46 (10): 52–56. doi:10.1063/1.881384.
^ Matthias, B. T.; Geballe, T. H.; Geller, S.; Corenzwit, E. Superconductivity of Nb3Sn. Physical Review. 1954, 95 (6): 1435–1435. Bibcode:1954PhRv...95.1435M. doi:10.1103/PhysRev.95.1435. 引文使用过时参数coauthors (帮助)
^ Kòrösy, F. Reaction of Tantalum, Columbium and Vanadium with Iodine. Journal of the American Chemical Society. 1939, 61 (4): 838–843. doi:10.1021/ja01873a018.
^ Ikenberry, Luther; Martin, J. L.; Boyer, W. J. Photometric Determination of Columbium, Tungsten, and Tantalum in Stainless Steels. Analytical Chemistry. 1953, 25 (9): 1340–1344. doi:10.1021/ac60081a011. 引文使用过时参数coauthors (帮助)
^ 21.021.121.2 Rayner-Canham, Geoff; Zheng, Zheng. Naming elements after scientists: an account of a controversy. Foundations of Chemistry. 2008, 10 (1): 13–18. doi:10.1007/s10698-007-9042-1. 引文使用过时参数coauthors (帮助)
^ 22.022.122.222.322.4 Patel, Zh.; Khul'ka K. Niobium for Steelmaking. Metallurgist. 2001, 45 (11–12): 477–480. doi:10.1023/A:1014897029026. 引文使用过时参数coauthors (帮助)
^ Norman N., Greenwood. Vanadium to dubnium: from confusion through clarity to complexity. Catalysis Today. 2003, 78 (1–4): 5–11. doi:10.1016/S0920-5861(02)00318-8.
^ 24.024.124.224.324.424.524.624.724.8 Nowak, Izabela; Ziolek, Maria. Niobium Compounds: Preparation, Characterization, and Application in Heterogeneous Catalysis. Chemical Reviews. 1999, 99 (12): 3603–3624. PMID 11849031. doi:10.1021/cr9800208.
^ 25.025.1 Peiniger, M.; Piel, H. A Superconducting Nb3Sn Coated Multicell Accelerating Cavity. Nuclear Science. 1985, 32 (5): 3610. Bibcode:1985ITNS...32.3610P. doi:10.1109/TNS.1985.4334443. 引文使用过时参数coauthors (帮助)
^ Salles Moura, Hernane R.; Louremjo de Moura, Louremjo. Melting And Purification Of Niobium. AIP Conference Proceedings (American Institute of Physics). 2007, (927(Single Crystal – Large Grain Niobium Technology)): 165–178. ISSN 0094-243X. 引文使用过时参数coauthor (帮助)[永久失效連結]
^ Jahnke, L.P.; Frank, R.G.; Redden, T.K. Columbium Alloys Today. Metal Progr. 1960, 77 (6): 69–74. OSTI 4183692. 引文使用过时参数coauthors (帮助)
^ Nikulina, A. V. Zirconium-Niobium Alloys for Core Elements of Pressurized Water Reactors. Metal Science and Heat Treatment. 2003, 45 (7–8): 287–292. doi:10.1023/A:1027388503837.
^ Lide, David R. The Elements. CRC Handbook of Chemistry and Physics 85. CRC Press. 2004: 4–21. ISBN 978-0-8493-0485-9.
^ Dean, J. A. Lange's Handbook of Chemistry 15th Edition. McGraw-Hill. 1999. ISBN 9780070163843. 引文格式1维护:冗余文本 (link)
^ 31.031.131.2 Georges, Audi; Bersillon, O.; Blachot, J.; Wapstra, A.H. The NUBASE Evaluation of Nuclear and Decay Properties. Nuclear Physics A (Atomic Mass Data Center). 2003, 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
^ Emsley, John. Niobium. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. 2001: 283–286. ISBN 0-19-850340-7.
^ 33.033.133.233.3 Soisson, Donald J.; McLafferty, J. J.; Pierret, James A. Staff-Industry Collaborative Report: Tantalum and Niobium. Industrial and Engineering Chemistry. 1961, 53 (11): 861–868. doi:10.1021/ie50623a016. 引文使用过时参数coauthors (帮助)
^ Lumpkin, Gregory R.; Ewing, Rodney C. Geochemical alteration of pyrochlore group minerals: Pyrochlore subgroup (PDF). American Mineralogist. 1995, 80: 732–743. 引文使用过时参数coauthor (帮助)
^ 35.035.135.2 Kouptsidis, J; Peters, F.; Proch, D.; Singer, W. Niob für TESLA (PDF). Deutsches Elektronen-Synchrotron DESY. [2008-09-02]. (原始内容 (PDF)存档于2008-12-17) (德语). 引文使用过时参数coauthors (帮助)
^ 36.036.136.236.336.436.536.6 Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils;. Niob. Lehrbuch der Anorganischen Chemie 91–100. Walter de Gruyter. 1985: 1075–1079. ISBN 3-11-007511-3 (德语). 引文使用过时参数coauthors (帮助)
^ A Review of Niobium-Tantalum Separation in Hydrometallurgy (PDF). 2011: 248.
^ A Review of Niobium-Tantalum Separation in Hydrometallurgy. 2011: 248. (原始内容存档于2016年12月24日).
^ Tither, Geoffrey. Minerals, Metals and Materials Society, Metals and Materials Society Minerals, 编. Progress in Niobium Markets and Technology 1981–2001 (PDF). Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA) (Niobium 2001 Ltd, 2002). 2001. ISBN 978-0-9712068-0-9. (原始内容 (PDF)存档于2008-12-17).
^ Dufresne, Claude; Goyette, Ghislain. Minerals, Metals and Materials Society, Metals and Materials Society Minerals, 编. The Production of Ferroniobium at the Niobec mine 1981–2001 (PDF). Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA) (Niobium 2001 Ltd, 2002). 2001. ISBN 978-0-9712068-0-9. (原始内容 (PDF)存档于2008-12-17). 引文使用过时参数coauthor (帮助)
^ 41.041.1 Agulyansky, Anatoly. The Chemistry of Tantalum and Niobium Fluoride Compounds. Elsevier. 2004: 1–11. ISBN 978-0-444-51604-6.
^ Choudhury, Alok; Hengsberger, Eckart. Electron Beam Melting and Refining of Metals and Alloys. The Iron and Steel Institute of Japan International. 1992, 32 (5): 673–681. doi:10.2355/isijinternational.32.673. 引文使用过时参数coauthors (帮助)
^ Lucchesi, Cristane; Cuadros, Alex, Mineral Wealth, Bloomberg Markets (paper), April 2013: 14
^ Papp, John F. Niobium (Columbium) (PDF). USGS 2006 Commodity Summary. [2008-11-20].
^ 45.045.1 Papp, John F. Niobium (Columbium) (PDF). USGS 2007 Commodity Summary. [2008-11-20].
^ Papp, John F. Niobium (Columbium) (PDF). USGS 1997 Commodity Summary. [2008-11-20].
^ Niobium (Colombium) U.S. Geological Survey, Mineral Commodity Summaries, January 2011
^ Larry D. Cunningham. USGS Minerals Information: Niobium (Columbium) and Tantalum. Minerals.usgs.gov. 2012-04-05 [2012-08-17].
^ Craig, Bruce D.; Anderson, David S. Handbook of Corrosion Data. ASM International. 1994: 439. ISBN 9780871705181.
^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
^ Cardarelli, Francois. Materials Handbook. Springer London. 2008. ISBN 978-1-84628-668-1.
^ Rahtu, Antti. Atomic Layer Deposition of High Permittivity Oxides: Film Growth and In Situ Studies (Thesis). University of Helsinki. 2002. ISBN 952-10-0646-3.
^ Maruyama, Toshiro. Electrochromic Properties of Niobium Oxide Thin Films Prepared by Chemical Vapor Deposition. Journal of the Electrochemical Society. 1994, 141 (10): 2868. doi:10.1149/1.2059247.
^ C. R. Lucas, J. A. Labinger, J. Schwartz. Robert J. Angelici, 编. Dichlorobis(η5-Cyclopentadienyl)Niobium(IV). Inorganic Syntheses. Inorganic Syntheses (New York: J. Wiley & Sons). 1990, 28: 267–270. ISBN 0-471-52619-3. doi:10.1002/9780470132593.ch68.
^ 申泮文, 车云霞, 罗裕基 等. 无机化学丛书 第八卷 钛分族 钒分族 铬分族. 科学出版社, 1982. 3.4.3 铌(IV)和钽(IV)的卤化物及卤氧化物. pp 323
^ Gjikaj, M. Synthesis, crystal structure and vibrational spectrum of 2,3,5. 2009: 9.
^ Greenwood, Norman N.; Earnshaw, Alan., Chemistry of the Elements 2nd, Oxford: Butterworth-Heinemann, 1997, ISBN 0080379419
^ Verevkin, A.; Pearlman, A.; Slstrokysz, W.; Zhang, J.; Currie, M.; Korneev, A.; Chulkova, G.; Okunev, O.; Kouminov, P.; Smirnov, K.; Voronov, B.; N. Gol'tsman, G.; Sobolewski, Roman. Ultrafast superconducting single-photon detectors for near-infrared-wavelength quantum communications. Journal of Modern Optics. 2004, 51 (12): 1447–1458. doi:10.1080/09500340410001670866. 引文使用过时参数coauthors (帮助)
^ Woydt, Mathias; Mohrbacher, Hardy. The use of niobium carbide (NbC) as cutting tools and for wear resistant tribosystems. International Conference on the Science of Hard Materials. 2015, 49 (10): 212–218. doi:10.1016/j.ijrmhm.2014.07.002.
^ 60.060.1 Papp, John F. Niobium (Columbium ) and Tantalum (PDF). USGS 2006 Minerals Yearbook. [2008-09-03].
^ 61.061.1 Heisterkamp, Friedrich; Tadeu Carneiro. Minerals, Metals and Materials Society, Metals and Materials Society Minerals, 编. Niobium: Future Possibilities – Technology and the Market Place (PDF). Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA) (Niobium 2001 Ltd, 2002). 2001. ISBN 978-0-9712068-0-9. (原始内容 (PDF)存档于2008-12-17). 引文使用过时参数coauthors (帮助)
^ Eggert, Peter; Priem, Joachim; Wettig, Eberhard. Niobium: a steel additive with a future. Economic Bulletin. 1982, 19 (9): 8–11. doi:10.1007/BF02227064. 引文使用过时参数coauthors (帮助)
^ Hillenbrand, Hans–Georg; Gräf, Michael; Kalwa, Christoph. Development and Production of High Strength Pipeline Steels (PDF). Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA) (Europipe). 2001-05-02. 引文使用过时参数coauthors (帮助)
^ Donachie, Matthew J. Superalloys: A Technical Guide. ASM International. 2002: 29–30. ISBN 978-0-87170-749-9.
^ Bhadeshia, H. k. d. h. Nickel Based Superalloys. University of Cambridge. [2008-09-04]. (原始内容存档于2006-08-25).
^ Pottlacher, G.; Hosaeus, H.; Wilthan, B.; Kaschnitz, E.; Seifter, A. Thermophysikalische Eigenschaften von festem und flüssigem Inconel 718. Thermochimica Acta. 2002, 382 (1––2): 55–267. doi:10.1016/S0040-6031(01)00751-1 (德语). 引文使用过时参数coauthors (帮助)
^ Dunn, Barrie D. Chapter 8.6 Decelerators and Heat Shield Materials. Materials and Processes: for Spacecraft and High Reliability Applications. Springer. 2015: 524. ISBN 9783319233628.
^ 68.068.1 Hebda, John. Niobium alloys and high Temperature Applications. Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA) (Companhia Brasileira de Metalurgia e Mineração). 2001-05-02. (原始内容 (PDF)存档于2016-12-20).
^ Lindenhovius, J.L.H.; Hornsveld, E.M.; Den Ouden, A.; Wessel, W.A.J.; Ten Kate, H.H.J. Powder-in-tube (PIT) Nb/sub 3/Sn conductors for high-field magnets. IEEE Transactions on Applied Superconductivity. 2000, 10: 975–978. doi:10.1109/77.828394.
^ Nave, Carl R. Superconducting Magnets. Georgia State University, Department of Physics and Astronomy. [2008-11-25].
^ Glowacki, B. A.; Yan, X. -Y.; Fray, D.; Chen, G.; Majoros, M.; Shi, Y. Niobium based intermetallics as a source of high-current/high magnetic field superconductors. Physica C: Superconductivity. 2002,. 372–376 (3): 1315–1320. Bibcode:2002PhyC..372.1315G. arXiv:cond-mat/0109088. doi:10.1016/S0921-4534(02)01018-3. 引文使用过时参数coauthors (帮助)
^ Grunblatt, G.; Mocaer, P.; Verwaerde Ch.; Kohler, C. A success story: LHC cable production at ALSTOM-MSA. Fusion Engineering and Design (Proceedings of the 23rd Symposium of Fusion Technology). 2005, 75–79: 1–5. doi:10.1016/j.fusengdes.2005.06.216. 引文使用过时参数coauthor (帮助)
^ Lilje, L.; Kakob, E.; Kostina, D.; Matheisena, A.; Möllera, W. -D.; Procha, D.; Reschkea, D.; Saitob, K. Schmüserc, P.; Simrocka, S.; Suzukid T.; Twarowskia, K. Achievement of 35 MV/m in the superconducting nine-cell cavities for TESLA. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 2004, 524 (1–3): 1–12. Bibcode:2004NIMPA.524....1L. arXiv:physics/0401141. doi:10.1016/j.nima.2004.01.045. 引文使用过时参数coauthors (帮助)
^ Cherednichenko, Sergey; Drakinskiy, Vladimir; Berg, Therese; Khosropanah, Pourya; Kollberg, Erik. A Hot-electron bolometer terahertz mixers for the Herschel Space Observatory. Review of Scientific Instruments. 2008, 79 (3): 0345011–03451010. Bibcode:2008RScI...79c4501C. PMID 18377032. doi:10.1063/1.2890099. 引文使用过时参数coauthors (帮助)
^ Volk, Tatyana; Wohlecke, Manfred. Lithium Niobate: Defects, Photorefraction and Ferroelectric Switching. Springer. 2008: 1–9. ISBN 978-3-540-70765-3. 引文使用过时参数coauthors (帮助)
^ Pozdeev, Y. Reliability comparison of tantalum and niobium solid electrolytic capacitors. Quality and Reliability Engineering International. 1991, 14 (2): 79–82. doi:10.1002/(SICI)1099-1638(199803/04)14:2<79::AID-QRE163>3.0.CO;2-Y.
^ Mallela, Venkateswara Sarma; Ilankumaran, V.; Srinivasa Rao, N. Trends in Cardiac Pacemaker Batteries. Indian Pacing Electrophysiol J. 1 January 2004, 4 (4): 201–212. PMC 1502062. PMID 16943934. 引文使用过时参数coauthors (帮助)
^ Godley, Reut; Starosvetsky, David; Gotman, Irena. Bonelike apatite formation on niobium metal treated in aqueous NaOH (PDF). Journal of Materials Science: Materials in Medicine. 2004, 15 (10): 1073–1077. PMID 15516867. doi:10.1023/B:JMSM.0000046388.07961.81. 引文使用过时参数coauthors (帮助)
^ Biason Gomes, M. A.; Onofre, S.; Juanto, S.; Bulhões, L. O. de S. Anodization of niobium in sulphuric acid media. Journal of Applied Electrochemistry. 1991, 21 (11): 1023–1026. doi:10.1007/BF01077589. 引文使用过时参数coauthors (帮助)
^ Chiou, Y. L. A note on the thicknesses of anodized niobium oxide films. Thin Solid Films. 1971, 8 (4): R37–R39. Bibcode:1971TSF.....8R..37C. doi:10.1016/0040-6090(71)90027-7.
^ Azevedo, C. R. F.; Spera, G.; Silva, A. P. Characterization of metallic piercings that caused adverse reactions during use. Journal of Failure Analysis and Prevention. 2002, 2 (4): 47–53. doi:10.1361/152981502770351860. 引文使用过时参数coauthors (帮助)
^ Grill, Robert; Gnadenberge, Alfred. Niobium as mint metal: Production–properties–processing. International Journal of Refractory Metals and Hard Materials. 2006, 24 (4): 275–282. doi:10.1016/j.ijrmhm.2005.10.008. 引文使用过时参数coauthors (帮助)
^ 25 Euro – 150 Years Semmering Alpine Railway (2004). Austrian Mint. [2008-11-04]. (原始内容存档于2011-07-21).
^ 150 Jahre Semmeringbahn. Austrian Mint. [2008-09-04]. (原始内容存档于2011-07-20) (德语).
^ $5 Sterling Silver and Niobium Coin – Hunter's Moon (2011). Royal Canadian Mint. [1 February 2012].
^ Henderson, Stanley Thomas; Marsden, Alfred Michael; Hewitt, Harry. Lamps and Lighting. Edward Arnold Press. 1972: 244–245. ISBN 0-7131-3267-1. 引文使用过时参数coauthors (帮助)
^ Eichelbrönner, G. Refractory metals: crucial components for light sources. International Journal of Refractory Metals and Hard Materials. 1998, 16 (1): 5–11. doi:10.1016/S0263-4368(98)00009-2.
^ Michaluk, Christopher A.; Huber, Louis E.; Ford, Robert B. Minerals, Metals and Materials Society, Metals and Materials Society Minerals, 编. Niobium and Niobium 1% Zirconium for High Pressure Sodium (HPS) Discharge Lamps. Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA) (Niobium 2001 Ltd, 2002). 2001. ISBN 978-0-9712068-0-9. 引文使用过时参数coauthors (帮助)
^ US5,254,836 (於1993年10月19日注册) Okada, Yuuji; Kobayashi, Toshihiko; Sasabe, Hiroshi; Aoki, Yoshimitsu; Nishizawa, Makoto; Endo, Shunji——Method of arc welding with a ferrite stainless steel welding rod。
^ Moavenzadeh, Fred. Concise Encyclopedia of Building and Construction Materials. MIT Press. 14 March 1990: 157– [18 February 2012]. ISBN 978-0-262-13248-0.
^ Cardarelli, François. Materials handbook: a concise desktop reference. Springer. 9 January 2008: 352– [18 February 2012]. ISBN 978-1-84628-668-1.
^ Vilaplana, J.; Romaguera, C.; Grimalt, F.; Cornellana, F. New trends in the use of metals in jewellery. Contact Dermatitis. 1990, 25 (3): 145–148. PMID 1782765. doi:10.1111/j.1600-0536.1991.tb01819.x. 引文使用过时参数coauthors (帮助)
^ Vilaplana, J.; Romaguera, C. New developments in jewellery and dental materials. Contact Dermatitis. 1998, 39 (2): 55–57. PMID 9746182. doi:10.1111/j.1600-0536.1998.tb05832.x. 引文使用过时参数coauthors (帮助)
^ 94.094.1 Haley, Thomas J.; Komesu, N.; Raymond, K. Pharmacology and toxicology of niobium chloride. Toxicology and Applied Pharmacology. 1962, 4 (3): 385–392. PMID 13903824. doi:10.1016/0041-008X(62)90048-0. 引文使用过时参数coauthor (帮助)
^ Downs, William L.; Scott, James K.; Yuile, Charles L.; Caruso, Frank S.; Wong, Lawrence C. K. The Toxicity of Niobium Salts. American Industrial Hygiene Association Journal. 1965, 26 (4): 337–346. PMID 5854670. doi:10.1080/00028896509342740. 引文使用过时参数coauthors (帮助)
^ Schroeder, Henry A.; Mitchener, Marian; Nason, Alexis P. Zirconium, Niobium, Antimony, Vanadium and Lead in Rats: Life term studies. Journal of Nutrition. 1970, 100 (1): 59–68. PMID 5412131. 引文使用过时参数coauthors (帮助)
外部連結
Los Alamos National Laboratory – Niobium(洛斯阿拉莫斯國家實驗室﹣鈮)
Tantalum-Niobium International Study Center(國際鉭鈮研究中心)
Niobium for particle accelerators eg ILC. 2005鈮用於粒子加速器,國際直線對撞機,2005年
 Columbium. 大英百科全書 第十一版. 1911年.
Columbium. 大英百科全書 第十一版. 1911年.
 Columbium. New International Encyclopedia. 1905.
Columbium. New International Encyclopedia. 1905.
Niobium at The Periodic Table of Videos(諾丁漢大學)- 科學家經光譜學在高溫下發現NbCl,見:Ram, R.S.; Rinskopf, N.; Liévin, J.; Bernatha, P.F. Fourier transform emission spectroscopy and ab initio calculations on NbCl (PDF). Journal of Molecular Spectroscopy. 2004, 228 (2): 544–553. Bibcode:2004JMoSp.228..544R. doi:10.1016/j.jms.2004.02.001. (原始内容 (PDF)存档于2014-02-28). 引文使用过时参数coauthors (帮助)
元素周期表(过渡金属) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |
IA 1 |
IIA 2 |
IIIB 3 |
IVB 4 |
VB 5 |
VIB 6 |
VIIB 7 |
VIIIB 8 |
VIIIB 9 |
VIIIB 10 |
IB 11 |
IIB 12 |
IIIA 13 |
IVA 14 |
VA 15 |
VIA 16 |
VIIA 17 |
VIIIA 18 |
||||||||||||||||||
1 |
H |
|
He |
|||||||||||||||||||||||||||||||||
2 |
Li |
Be |
|
B |
C |
N |
O |
F |
Ne |
|||||||||||||||||||||||||||
3 |
Na |
Mg |
|
Al |
Si |
P |
S |
Cl |
Ar |
|||||||||||||||||||||||||||
4 |
K |
Ca |
|
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
|||||||||||||||||
5 |
Rb |
Sr |
|
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
|||||||||||||||||
6 |
Cs |
Ba |
La |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
||||
7 |
Fr |
Ra |
Ac |
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og |
||||
| ||||||||||||||||||||||||||||||||||||
| ||||||
|

Comments
Post a Comment