玻意耳-马略特定律
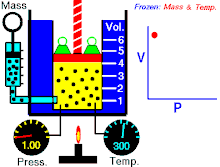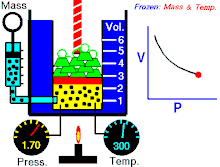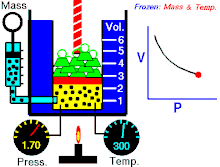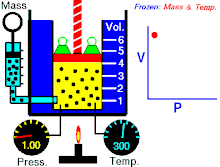
該動畫表現出,在質量和溫度不變時壓強和體積之間的關係。
波意耳-马略特定律(英语:Boyle's law,也稱作Boyle–Mariotte law或Mariotte's law),在定量定溫下,理想氣體的體積與壓強成反比。是由愛爾蘭化學家羅伯特·波以耳,在1662年根據實驗結果提出:「在密閉容器中的定量氣體,在恆溫下,氣體的压强和體積成反比關係。」稱之為波以耳定律:此定律实验结果首先由Henry Power[1]所发现。這是人類歷史上第一個被發現的「定律」。马略特在1676年发表在《气体的本性》论文中:一定质量的气体在温度不变时其体积和压强成反比。波以耳和马略特这两人是各自分别独立确立定律的,因此在英语国家,这一定律被称为波义耳定律,而在欧洲大陆则被称为马略特定律。
目录
1 公式
2 定義
3 波意耳定律與動力學理論和理想氣體之關係
4 參見
公式
- V=kp{displaystyle V={frac {k}{p}}}
這裡
- V 表示氣體的體積
- p 表示压强
- k 為一正常數
這個公式又可以繼續推導,理想氣體的體積與压强的乘積成為一定的常數。
- pV=k{displaystyle pV=k,}
如果在温度相同的狀態下,A、B兩種狀態下的氣體關係式可表示成。
- pAVA=pBVB{displaystyle p_{A}V_{A}=p_{B}V_{B},}
習慣上,這個公式會寫成
- p1/p2=V2/V1{displaystyle qquad p_{1}/p_{2}=V_{2}/V_{1}}
定義
定律本身可以陳述如下:指出在恆定溫度下的固定質量,絕對壓力和氣體的體積成反比。
當溫度恆定時若體積增大,壓力會減小,反之亦然。例如當體積減半,壓力會加倍或是體積加倍,壓力減半。
波意耳定律與動力學理論和理想氣體之關係
波意耳定律指出在恆定溫度下的固定質量,絕對壓力和氣體的體積成反比。該法也可在稍微不同的方式表示,即絕對壓力和體積總為常數。大多數氣體於中等壓力和溫度下的表現如同理想氣體。17世紀的技術不足無法產生高壓或低溫狀況,所以波義耳定律於發表時並無偏差。而隨科技進步,技術改良允許產生高壓及低溫的實驗狀況,理想氣體於極度實驗狀況下的偏差可被顯著的觀察到,所以壓力和容積之間的關係只能準確地描述實際氣體理論。此偏差也可表示為壓縮因子。
波意耳(和馬略特)衍生的定律來自實驗依據。該定律也可以由基於原子和分子存在理論、運動假設、完全彈性碰撞的假定存在的理論推導。這些假設是在實證主義科學界在當時遇到了巨大阻力,因為他們被視為純粹的理論構建且毫無觀測證據。
丹尼爾·伯努利在1737年至1738年用分子層面之牛頓運動定律得出波義耳定律 。而此結果被忽略直到1845年約翰·沃特斯頓發表的一篇動力學理論論文,然而此論文卻被英國皇家學會拒絕。直到詹姆斯·普雷斯科特·焦耳,魯道夫·克勞修斯以及路德维希·玻尔兹曼的作品才牢固建立了氣體動力學理論並促使人們關注伯努利和沃特斯頓兩者的理論。
能量學和原子論的支持者之間的爭論引起波茲曼於1898年寫一本書來釐清,而這本書經嚴厲批評導致波茲曼於1906年自殺。愛因斯坦在1905年發表理論動能適用於流體懸浮顆粒的布朗運動,此理論於1908年由讓·佩藍證實。
參見
- 氣體
- 阿伏伽德罗定律
- 查理定律
- 道尔顿分压定律
- 盖-吕萨克定律
- 格銳目定律
- 范德瓦耳斯方程
- 亨利定律
- 理想气体状态方程





Comments
Post a Comment